
- •Бодх Атомная физика и всё такое.
- •Что такое «модель»
- •Исторический срез.
- •Электричество и электроны
- •Планетарная модель атома.
- •Атом водорода.
- •Атом – это пустое место.
- •Нейтрон.
- •Общая схема атома – самая грубая.
- •Гелий и гелион. Массовое число атома. Атомное число.
- •Нуклеосинтез.
- •Какие элементы нам уже знакомы?
- •Атомная масса и атомное число.
- •Еще немного о массе энергии и энергии массы.
- •Другие химические элементы.
- •Несколько слов об «элементах».
- •Их так много, может они на самом деле «один и тот же»?
- •Электронвольты и ангстремы.
- •Энергия.
- •Вес и масса. И Луна.
- •Астрономическое отступление: происхождение Луны и интересов.
- •Периодичность свойств и постепенность увеличения атомного ядра.
- •Электроположительность и электроотрицательность.
- •Химические связи. Валентность и ковалентность.
- •Совместное владение электронами.
- •Электронные оболочки.
- •«Липкие молекулы». Водородная связь.
- •Силы Ван-дер-Ваальса.
- •Потенциальная яма.
- •Сантиметры, граммы и секунды. И джоули. И прочее.
- •Дополнительные сведения:
- •Изотопы водорода. Дейтерий, протий и тритий.
- •Ядерные реакции.
- •Нейтронная звезда.
- •Плазма.
- •Камера Уилсона.
- •Исключение из правил.
- •Период полураспада.
- •Радиоуглеродный метод.
- •Медленные нейтроны.
- •Отступление… из физики!
- •Измерение массы заряженных частиц.
- •Магнетизм.
- •Масс-спектрограф.
- •Островки стабильности – земля Санникова
- •История Земли Санникова
- •Ядерные задачки.
- •1) Полоний – продукт распада изотопа радона 222Rn. Период полураспада радона равен примерно 4 дням. Через сколько дней число ядер полония будет в 3 раза превышать число ядер радона?
- •Интерференция электронов.
- •Еще о медузах, слонах и звуках.
- •Как измерили заряд электрона.
- •Супер-сверх-мега-отступление.
- •Универсальный принцип дополнительности.
- •Химическая основа жизни.
- •Поляризация.
- •Спектр. Инфракрасные и ультрафиолетовые лучи.
- •Рентгеновские лучи.
- •Радиоактивность.
- •Отдельное «спасибо» от Дарвина.
- •Фотоэффект. Кванты.
- •Модель атома Бора.
- •Квантование.
- •Спектральный анализ.
- •Кентавры.
- •Матричная механика.
- •Радар и диктатура пролетариата.
- •Туннельный эффект.
- •Желания радостные и механические.
- •Мезоны.
- •Мезоновый зоопарк.
- •Барионы и адроны. Барионный заряд.
- •Мюоны. Космические лучи. Чудесные атомы будущего.
- •Природа электрического поля.
- •Античастицы. Аннигиляция.
- •Взаимодействие с пустотой. Очередная нелепость?
- •Вероятность. Экспонента.
- •Магнетар
- •Цепная реакция
- •Солнечный ветер. Гелиосфера.
- •Физика и удовольствие от геологии
- •Кинетическая энергия: mv или mv2 ?
- •Список клёвых книг по физике.
«Липкие молекулы». Водородная связь.
Молекула – наименьшая частица вещества, несущая его химические свойства. Она состоит из двух или более атомов, имеет определенную структуру расположения этих атомов. Например, мы можем делить поваренную соль на все более мелкие частички, пока не доберемся до одинокой пары Na+Cl. Эта пара будет иметь все обычные химические свойства соли, но если мы разобьем ее – одинокие атомы натрия и хлора перестанут иметь химические свойства соли, они по отдельности не будут вступать в те же реакции, что и NaCl.
Атом фтора, каким бы голодным он ни был, не может полностью отнять электрон у водорода – он лишь сильно смещает его в свою сторону. Электрон, грубо говоря, становится ближе к центру атома фтора, чем к центру атома водорода.
Это означает, что если провести воображаемую линию через центр молекулы фтороводорода (HF), то у стороны фтора будет отрицательный заряд, а у стороны водорода – равный ему положительный. О таком явлении говорят, что молекула фтороводорода сильно «полярна».
П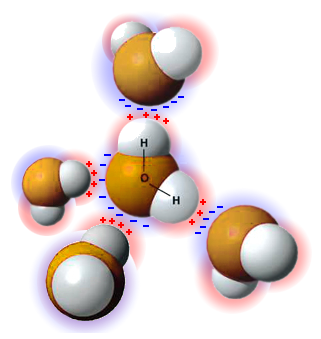 очти
то же самое можно сказать о молекулах
воды (H2O)
и аммиака (NH3). Такие
молекулы имеют положительно и отрицательно
заряженные полюса. Что будет, если
положительно заряженный конец одной
молекулы приблизится к отрицательно
заряженному концу другой? Они, конечно,
притянутся друг к другу, словно слипнутся.
очти
то же самое можно сказать о молекулах
воды (H2O)
и аммиака (NH3). Такие
молекулы имеют положительно и отрицательно
заряженные полюса. Что будет, если
положительно заряженный конец одной
молекулы приблизится к отрицательно
заряженному концу другой? Они, конечно,
притянутся друг к другу, словно слипнутся.
Подобного эффекта мы не увидим в молекуле H2S, например (несмотря на то, что ее структура похожа на молекулу воды) – просто потому, что сера – не такой сильный электроотрицательный элемент, как кислород, и не может заметно сдвинуть в свою сторону электрон, принадлежащий водороду. Поэтому H2S не очень полярна.
Атом водорода в молекуле воды граничит с атомом кислорода из той же самой молекулы. Но к этой молекуле в силу ее полярности примыкает еще одна молекула воды, развернутая так, чтобы ее отрицательно заряженная сторона соприкасалась с положительно заряженной стороны первой молекулы. А это значит, что соседняя молекула разместится так, чтобы к атому водорода первой молекулы примыкал атом кислорода второй молекулы. Таким образом атом водорода оказывается «зажат» между двумя атомами кислорода – одним своим и одним из соседней молекулы, и такую связь, за счет которой молекулы воды словно слипаются, называют «водородной». Водородная связь – один из видов химических связей.
Водородная связь слабее обычной химической связи в двадцать раз, но ее наличие оказывает грандиозное влияние на нашу жизнь. Поскольку молекулы воды «слипаются» указанным выше способом, то требуются значительно более высокие температуры, чтобы оторвать их друг от друга, чем если бы молекулы были неполярными. Если бы не было этого эффекта, скрепляющего между собой молекулы воды, вода закипала бы при температуре минус 70 градусов! Какой была бы тогда жизнь, если бы была вообще? В силу повышенной «липкости» молекул, вода может поглощать так много тепла при повышении температуры на каждый градус, ведь ее молекулы тесно связаны между собой, и их трудно «раскачать», то есть трудно повысить температуру воды. Это значит, что если долго и сильно нагревать воду, то ее молекулы начнут лишь немного больше раскачиваться, то есть температура воды поднимается очень медленно, поэтому океан нагревается гораздо медленнее, чем суша, под лучами солнца.
Верно и обратное – вода способна отдавать много тепла при падении температуры, то есть если вода остынет лишь немного, она при этом в окружающую атмосферу отдаст много тепла – столько же, сколько понадобилось, чтобы нагреть воду.
Поэтому мы говорим, что вода имеет чрезвычайно высокую «теплоемкость», то есть ведет себя как огромная теплогубка. Она забирает и отдает больше тепла, чем любое другое вещество при одном и том же изменении температуры, и охлаждается медленнее, работая как термостат, сохраняющий мягкий климат на Земле.
