
- •Формирование структуры литых металлов
- •Строение и свойства сплавов. Диаграммы состояния бинарных сплавов.
- •Механические свойства и способы определения их количественных характеристик
- •Диаграмма состояния железо-углерод
- •Рост зерна аустенита при нагреве
- •Превращение аустенита при непрерывном охлаждении
- •Технология термической обработки стали
- •Отпуск стали
- •Химико-термическая обработка
- •Конструкционные стали
- •Хромоо-никелевые нержавеющие стали:
- •Алюминиевые бронзы
Материаловедение – это наука, изучающая строение и свойства материалов и устанавливающая связь между составом, строением и свойствами
Строение и свойства чистых металлов. Все металлы делятся на 2 большие группы: черные, цветные. Черные имеют темно-серый цвет, большую плотность, высокую температуру плавления, относительно высокую твердость. Наиболее типичным представителем является железо. Цветные имеют характерную окраску – красную, желтую, белую. Они пластичны, обладают малой твердостью, имеют низкую температуру плавления. Типичным представителем является медь.
Черные металлы согласно классификации, предложенной А.П.Гуляевым подразделяются: Железные металлы – железо, кобальт, никель (ферромагнетики). Тугоплавкие, с температурой плавления больше, чем у железа. Урановые ( актиниды) Редкоземельные металлы (РЗМ), лантан, церий и др. Щелочноземельные
Цветные металлы подразделяются: Легкие металлы – берилий, магний, алюминий, с плотностью меньше 5 г/смз Благородные – серебро, золото, платина и и др. Легкоплавкие – цинк, кадмий, ртуть, олово , с температурой плавления меньше 1000о.
Металлы можно охарактеризовать такими свойствами: высокая теплопроводность; электропроводность, которая с понижением температуры повышается, причем некоторые металлы имеют сверхпроводимость; пластичность ; металлический; магнитные свойства; постоянная температура кристаллизации. Все металлы – тела кристаллические.
В природе существует два типа построения твердых тел их атомов – тела могут быть кристаллические и аморфные. Аморфные тела – это такие тела, в которых атомы расположены беспорядочно, хаотически. В отличие от жидкостей они имеют пониженную подвижность частиц. Кристаллические тела – это такие тела, в которых атомы расположены в строго определенном порядке, в строго определенной последовательности.
В зависимости от размеров структурных составляющих и методов их выявления различают: тонкую структуру – описывает расположение частиц в кристалле и электронов в атоме . Изучается дифракционными методами – рентгенографией и т.д.; микроструктуру –состоящую из мелких кристалликов, зерен, ее наблюдают с помощь. оптических или электронных микроскопов. макроструктуру – изучаемую невооруженным глазом или при небольших увеличениях. Выявляет изломы, раковины, поры.
Под атомно-кристаллической структурой металлов понимают взаимное расположение атомов, существующее в кристалле. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой расположены атомы.

а, г – ГПУ (гексагональная плотноупакованная); б, д – ГЦК (гранецентрированная кубическая); в, е – ОЦК (объемноцентрированная кубическая)

Размеры элементарной ячейки кристаллической решетки оценивают отрезки а,в, с. Их называют периодами решетки. Плотность кристаллической решетки- объема, занятого атомами, характеризуется координационным числом – К – число атомов, находящихся на равном и наименьшем расстоянии от анного атома.
Полиморфизм (аллотропия) – способность металла принимать различные кристаллические формы при разных температурах. Анизотропия – это зависимость свойств кристалла от направления. Возникает в результате упорядоченного расположения атомов в пространстве.
ДЕФЕКТЫ КРИСТАЛЛОВ: Точечные дефекты(вакансии); Основными линейными дефектами являются дислокации; Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.(винтовая, краевая).
Формирование структуры литых металлов
Любое вещество может находиться в трех агрегатных состояниях: Твердом ,Жидком Газообразном
Переход металла из жидкого состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией.
Кристаллы могут зарождаться самопроизвольно – самопроизвольная кристаллизация. Или расти на имеющихся готовых центрах кристаллизации – несамопроизвольная кристаллизация. Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением свободной энергии или термодинамического потенциала. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации. Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения.
Процесс перехода металла из жидкого состояния в твердое можно изобразить графически в координатах температура – время по так называемым кривым охлаждения. Процесс кристаллизации состоит из двух элементарных процессов: зарождения мельчайших зародышей или центров кристаллизации; роста кристаллов из этих центров.
Строение металлического слитка. Слиток состоит из трех зон: мелкокристаллическая корковая зона; зона столбчатых кристаллов; внутренняя зона крупных равноосных кристаллов.
Правило фаз – это закон, выражающий соотношение между числом фаз Ф, числом компонентов К, внешних переменных В и числом степеней свободы для равновесной температуры. ФАЗА – это однородная часть системы, ограниченная от другой части системы поверхностью раздела при переходе через которую свойства изменяются скачкообразно. КОМПОНЕНТАМИ системы называют химические соединения или элементы, из которых может быть образована любая система. Это может быть один металл или элементы сплава. ЧИСЛОМ СТЕПЕНЕЙ СВОБОДЫ – или ВАРИАНТНОСТЬЮ СИСТЕМЫ называют количество факторов ( концентрация, температура, давление), которые можно произвольно изменять без изменения числа фаз системы.
Математически выражение правила фаз имеет вид: С = К - Ф + 1 , где К – количество компонентов, образующих систему Ф- число фаз в системе В – число внешних переменных. Если С =0, то такое равновесие называется НОНВАРИАНТНЫМ. При нонвариантном равновесии сплав из данного числа фаз может существовать только в совершенно определенных условиях - при постоянной температуре. На кривой охлаждения – площадка. Если С = 1, то система называется МОНОВАРИАНТНОЙ, система находится не в равновесии, следовательно, температура меняется – на кривой перегиб
Строение и свойства сплавов. Диаграммы состояния бинарных сплавов.
Металлическим сплавом называют вещество, полученное сплавлением двух или более компонентов.
Из однородного жидкого раствора может образоваться однородный твердый раствор, механическая смесь или эвтектика или кристаллическое химическое соединение.
В зависимости от характера взаимодействия компонентов различают сплавы: механические смеси; химические соединения; твердые растворы.
Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам. Сплав состоит из кристаллов входящих в него компонентов. В сплавах сохраняются кристаллические решетки компонентов.
Твердые растворы- это фазы, кристаллические решетки которых состоят из атомов отдельных компонентов. В твердых растворах один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого, располагаясь в решетке первого компонента (растворителя), изменяя ее размеры (периоды). Т.о. твердые растворы имеют один тип решетки и представляют собой одну фазу. Различают твердые растворы внедрения и замещения.
Химические соединения – они образованы по закону нормальной валентности . При образовании химических соединений соотношение чисел атомов элементов соответствует стехиометрической пропорции, что может быть выражено простой формулой АnВm.
Химические соединения имеют следующие характерные особенности: кристаллическая решетка хим.соед. отличается от решеток компонентов, образующих их; Свойства его резко отличаются от свойств исходных компонентов; Они имеют постоянную температуру плавления; Образование их сопровождается значительным тепловым эффектом.
Эвтектика – это механическая смесь микроскопически мелких частиц. Механическая смесь двух компонентов А и В образуется тогда, когда они не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Диаграммы состояния – это графическое изображение состояния ( фазового состав, структуры) любого сплава системы в зависимости от температуры и концентрации. Диаграммы состояния строят в координатах температура – концентрация.
Типы диаграмм состояния
Диаграмма состояния сплавов, компоненты которых нерастворимы друг в друге в твердом состоянии
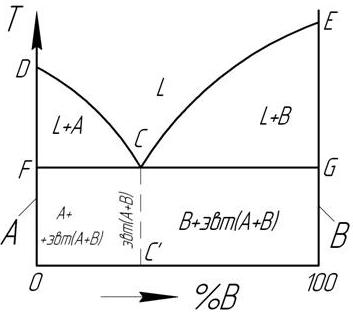
ПРАВИЛО ОТРЕЗКОВ. 1 – правило концентраций- позволяет определить составы (концентрации) фаз. 2- правило рычага – определяет количественные соотношения фаз в процессе кристаллизации для любого сплава системы.
Диаграмма состояния сплавов, компоненты которых нерастворимы друг в друге в твердом состоянии
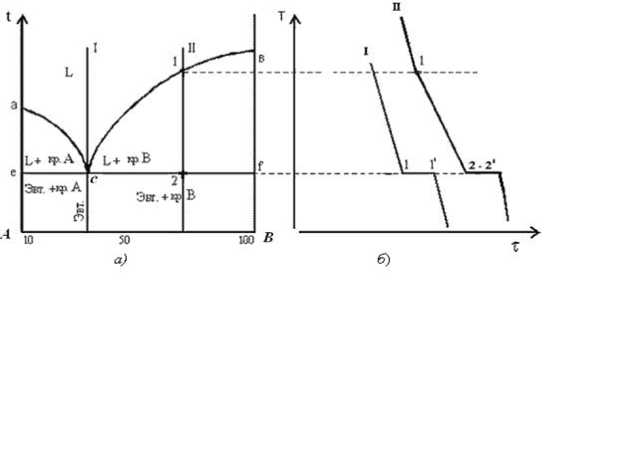
Диаграмма состояния с ограниченной растворимостью компонентов в твердом виде


Диаграмма состояния с устойчивым химическим соединением

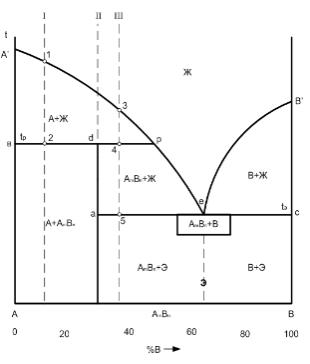
Диаграмма состояния с ограниченной растворимостью и, так называемой, перитектической реакцией

Диаграмма состояния с хим. соединением образующимся по перитектической реакции
Связь между свойствами сплавов и типом диаграммы состояния
Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым

При образовании механических смесей свойства изменяются по линейному закону. Значения характеристик свойств сплава находятся в интервале между характеристиками чистых компонентов.
При образовании твердых растворов с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости.
При образовании твердых растворов с ограниченной растворимостью свойства в интервале концентраций, отвечающих однофазным твердым растворам, изменяются по криволинейному закону, а в двухфазной области – по линейному закону.
