
- •Питання на 3-и бали:
- •8. Розкажіть про метод Фольварда.
- •9. Розкажіть про метод Фаянса.
- •11. Як взаємодіють двохвалентні метали з комплексоном ііі? Чи можна методом комплексонометрії визначити трьохвалентні метали?
- •12. Розкажіть про специфічні індикатори методу комплексонометрії.
- •13. Розкажіть про металохромні індикатори методу комплексонометрії.
- •14. Розкажіть про еріохром чорний індикатор.
- •15. Розкажіть про індикатор мурексид.
- •Задачі на 4-и бали:
- •Розв’язок:
- •Відповіді:
- •Розв’язок:
- •Відповіді:
- •Розв’язок:
- •Відповіді:
- •Відповіді:
- •Розв’язок:
- •Відповіді:
11. Як взаємодіють двохвалентні метали з комплексоном ііі? Чи можна методом комплексонометрії визначити трьохвалентні метали?
N aOOC – H2C CH2 – COONa
H
H

 N
– CH2 – CH2 – N
N
– CH2 – CH2 – N
O

 OC
– H2C CH2 –
COO
OC
– H2C CH2 –
COO
+
Me(2+)
‒ донорно-акцепторний зв’язок
Методом комплексонометрії можна визначити трьохвалентні метали. В такому випадку необхідно додати ще одну молекулу комплексна ІІІ.
12. Розкажіть про специфічні індикатори методу комплексонометрії.
Специфічні – це індикатори, які реагують тільки з певним металом.
Наприклад: Fe(3+) можна титрувати комплексоном ІІІ при рН = 2, використовуючи при цьому як індикатор роданід калію, саліцилат натрію, які дають забарвлені сполуки з Fe(3+).
13. Розкажіть про металохромні індикатори методу комплексонометрії.
Металохромні індикатори – це органічні речовини, найчастіше забарвлені та дають забарвлені сполуки з іонами різних металів. При певному значенні рН мають те, чи інше забарвлення. Вони утворюють із певними металами кислі або середні солі, які відрізняються між собою забарвленням.
Багато металохромних індикаторів є нестійкими при зберіганні у водних розчинах. Тому досить часто використовують щойно приготовлені розчини, або індикатори у твердому стані у вигляді порошку.
14. Розкажіть про еріохром чорний індикатор.
Еріохром чорний – це азобарвник із двома фенольними групами біля хромофорної азогрупи.
При рН 7-11 індикатор має синє забарвлення. Із катіонами Са(2+), Mg(2+), Zn(2+), Al(2+), Cu(2+), Mn(2+) утворює червоні комплекси.
При рН ˃12 має жовто-оранжеве забарвлення, яке важко відрізнити від червоного.
15. Розкажіть про індикатор мурексид.
Мурексид – це амонійна сіль фурфурної кислоти і при значеннях рН ˃9 має синьо фіолетове забарвлення. При рН˂9 – червоно-фіолетове.
16. Твердість води, чим вона зумовлена, які існують види твердості.
Твердість води – сукупність властивостей, зумовлених вмістом у воді катіонів кальцію та магнію.
Загальна твердість води зумовлена наявністю солей кальцію і магнію.
Тимчасова твердість води залежить від наявності у воді бікарбонатів цих металів і легко усуваються кип’ятінням.
Постійна твердість води зумовлена хлоридами і сульфатами кальцію і магнію. Вона не усувається під час кип’ятіння.
17. За якою формулою розраховують загальну твердість води?
Н
=
 , [
, [ ]
]
 -
молярна концентрація еквівалента ЕДТА;
-
молярна концентрація еквівалента ЕДТА;
 -
середнє значення об’єму ЕДТА, витраченого
на титрування;
-
середнє значення об’єму ЕДТА, витраченого
на титрування;
 -
об’єм аліквотної частини досліджуваного
розчину води, 10см3.
-
об’єм аліквотної частини досліджуваного
розчину води, 10см3.
18. За якими формулами визначають масу кальцію і магнію в одному розчині?
m(Са)
=
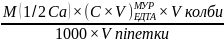
m(Mg)
=

 і
і
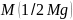 - молярна маса еквівалента, відповідно
кальцію і магнію;
- молярна маса еквівалента, відповідно
кальцію і магнію;
 -
концентрація ЕДТА;
-
концентрація ЕДТА;
 -
середнє значення об’єму ЕДТА витраченого
на титрування під впливом індикаторів,
відповідно еріохром чорного і мурексиду;
-
середнє значення об’єму ЕДТА витраченого
на титрування під впливом індикаторів,
відповідно еріохром чорного і мурексиду;
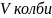 -
об’єм колби;
-
об’єм колби;
 – об’єм
піпетки.
– об’єм
піпетки.
19. Що таке меркурометрія?
Меркурометрія – це метод комплексоутворюючого титрування, оснований на утворенні комплексних сполук двохвалентного меркурію HgCl2, Hg(CN)2, Hg(SCN)2.
20. Які є недоліки і переваги реакцій комплексоутворення?
Недоіки:
Проходять ступінчасто.
Переваги:
Комплексні сполуки використовують для запобігання шкідливого впливу окремих іонів.
