
- •- Адсорбция ионов из растворов - Ионообменная адсорбция
- •Вопрос 15) Предельная молярная электрическая проводимость ионов ( о) – молярная электрическая проводимость электролита в бесконечном разбавленном растворе.
- •Вопрос 16) Кондуктометрия – это физико-химический метод анализа, основанный на измерении электрической проводимости жидких сред.
- •Вопрос 17) Величина, характеризующая способность вещества проводить электрический ток, называется электрическая проводимость.
- •Вопрос 21)
- •Вопрос 23)
- •Вопрос 24)
- •Вопрос 25) Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным или электродом определения.
- •Вопрос 26)
Вопрос 17) Величина, характеризующая способность вещества проводить электрический ток, называется электрическая проводимость.
Электрическая проводимость клеток и тканей в норме и при патологии.
Живой организм с точки зрения электрохимии можно рассматривать как открытую систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов.
Удельная электрическая
проводимость клеток составляет
приблизительно ,
а межклеточной жидкости -
,
а межклеточной жидкости -
 .
.
По электрической
проводимости биологические жидкости
и ткани можно расположить в такой
последовательности: кровь, лимфа, ликвор,
желчь мышечная
ткань, серое вещество мозга
ткань
легких, сердечная мышца, ткань
печени
жировая
ткань, костная ткань
роговой
слой эпидермиса кожи.
мышечная
ткань, серое вещество мозга
ткань
легких, сердечная мышца, ткань
печени
жировая
ткань, костная ткань
роговой
слой эпидермиса кожи.
Изменение электрической проводимости тканей и клеток широко используют для диагностических целей. Патологические процессы, а также отмирание тканей приводят к изменению проницаемости клеточных мембран. Это, в свою очередь, приводит к тому, что уменьшается зависимость электрической проводимости от частоты тока, а при полной гибели клеток она вообще перестает зависеть от частоты тока. Так как электрическая проводимость клеток и тканей определяется концентрацией свободных ионов, по электр. проводимости судят о проницаемости клеточных мембран для ионов. Повышение электрической проводимости указывает на увеличение содержания свободных ионов, а уменьшение – на то, что их концентрация падает. Сравнение электрических проводимостей цитоплазмы и водного раствора, имеющего изоионный состав, позволяет определить долю свободных и связанных ионов.
Вопрос 18) Если две фазы содержат заряженные частицы (ионы и электроны), то при их контакте возможен переход частиц в неэквивалентном количестве из одной фазы в другую фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется двойной электрический слой (ДЭС)
ДЭС – это упорядоченное распределение противоположно заряженных частиц на границе двух фаз.
ДЭС характеризуется возникновением скачка потенциала. В зависимости от природы соприкасающихся фаз различают четыре вида электрических потенциалов:
1. Электродный потенциал, возникающий на границе металл-раствор, содержащий катионы этого металла.
2. Окислительно-восстановительный (редокс) потенциал, возникающий на границе инертный металл-раствор, содержащий сопряженную окислительно-восстановительную пару.
3. Диффузионный потенциал, возникающий на границе двух растворов, содержащих разные ионы или разные концентрации одних и тех же ионов.
4. Мембранный потенциал, возникающий по обе стороны мембраны, обладающей избирательной проницаемостью, разделяющей растворы различной концентрации. В живом организме содержится множество различных соприкасающихся фаз, содержащих ионы, поэтому возникновение межфазных потенциалов имеет важное значение для жизнедеятельности организма.
Электродные потенциалы. Электрод состоит из металла (электронного проводника) и раствора соли этого металла (ионного проводника). Схема электрода:
Ме │ Меz+
электронный проводник ионный проводник
Величина потенциала на границе металл–раствор зависит от: а) природы металла; б) активности ионов металла в растворе; в) температуры.
Стандартный электродный
потенциал. Стандартный электродный
потенциал
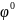 возникает
на границе металл–раствор при активности
потенциалопределяющих ионов в растворе
1 моль/л и Т = 298 К. Абсолютное значение
о измерить или рассчитать невозможно.
Определяют относительно стандартного
электрода. По Международному соглашению
в качестве стандартного электрода
используют стандартный водородный
электрод.
возникает
на границе металл–раствор при активности
потенциалопределяющих ионов в растворе
1 моль/л и Т = 298 К. Абсолютное значение
о измерить или рассчитать невозможно.
Определяют относительно стандартного
электрода. По Международному соглашению
в качестве стандартного электрода
используют стандартный водородный
электрод.
Вопрос 19) Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию за счет пространственного разделения процессов окисления и восстановления.
Гальванический элемент состоит из двух электродов, соединенных во внешней цепи металлическим проводником, а во внутренней цепи – электролитическим мостиком – стеклянной трубкой, заполненной насыщенным раствором КСl, или пористой перегородкой. В гальваническом элементе различают анод и катод.
Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно.
Катод – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается положительно.
Условная запись гальванического элемента:
(–) Анод | Анодный раствор || Катодный раствор | Катод (+)
Способность гальванического
элемента к переносу электронов во
внешней цепи характеризуется
электродвижущей силой (ЭДС). В обратимых
условиях ЭДС гальванического элемента
равна разности потенциалов катода и
анода: Е =
 (катода)
–
(анода).
(катода)
–
(анода).
ЭДС гальванического элемента зависит от: 1) природы электродов; 2) активности потенциалопределяющих ионов в анодном и катодном растворах; 3) температуры.
Вопрос 20) Мембранный потенциал возникает между сторонами избиратель- но проницаемой мембраны, разделяющей два раствора различного состава, в результате направленного перехода ионов через эту мембрану.
Электрические потенциалы устанавливаются на клеточных мембранах возбудимых клеток. К возбудимым клеткам относятся нервные, мышечные и железистые клетки. Электрический импульс может передаваться вдоль мембраны. Возникновение биоэлектрических потенциалов определяется, главным образом, калий – натриевой избирательностью мембран и неравно- мерным распределением ионов между клеткой и внеклеточной средой, которое поддерживается механизмами активного переноса ионов, локализованными в мембране.
Мембранные потенциалы клеток подразделяются на потенциалы по- коя и потенциалы действия. Потенциал покоя – мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.
Согласно теории Ходжкина-Хаксли-Катца клеточная мембрана в состоянии покоя проницаема в основном для ионов калия. Ионы калия диффундируют по градиенту концентраций через клеточную мембрану в окружающую жидкость, анионы не могут проникать через мембрану и ос- таются на ее внутренней стороне, поэтому внутренняя поверхность мембраны имеет отрицательный заряд, а внешняя – положительный. Измеренное значение потенциала покоя во многих случаях соответствует вычисленному по уравнению Нернста. В некоторых случаях между измеренной и вычисленной величинами имеются значительные отличия. Это объясняется тем, что на величину потенциала покоя оказывает влияние диффузия ионов натрия.
Потенциал действия – амплитуда колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клетки.
Потенциал действия, генерируемый нервной клеткой, может быть передан в мышечную клетку. Например, каждому биению сердца предшествует генерация большого по величине потенциала действия. Этот потенциал действия создает ток, который удается регистрировать с помощью электродов, размещенных на грудной клетке (электрокардиография).
