
- •- Адсорбция ионов из растворов - Ионообменная адсорбция
- •Вопрос 15) Предельная молярная электрическая проводимость ионов ( о) – молярная электрическая проводимость электролита в бесконечном разбавленном растворе.
- •Вопрос 16) Кондуктометрия – это физико-химический метод анализа, основанный на измерении электрической проводимости жидких сред.
- •Вопрос 17) Величина, характеризующая способность вещества проводить электрический ток, называется электрическая проводимость.
- •Вопрос 21)
- •Вопрос 23)
- •Вопрос 24)
- •Вопрос 25) Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным или электродом определения.
- •Вопрос 26)
1 Вопрос) Поверхностные явления происходят на границах раздела фаз и обусловлены особенностями состава и структуры поверхностей.
Абсорбция – самопроизвольный процесс поглощения веществ, при котором поглощаемые вещества (абсорбтивы) за счет диффузии распространяются по всему объему вещества – поглотителя (абсорбента).
Абсорбируемость газа жидкостью зависит от:
-Природы газа;
-Давления газа;
-Температуры;
-Присутствия электролитов.
Влияние природы газа:
Чем легче газ сжижается, тем сильнее он поглощается.
Влияние давления газа:
Абсорбция газов в жидкости подчиняется закону Генри:
При постоянной температуре абсорбция газа в единице объема жидкости прямо пропорциональна парциальному давлению этого газа в газовой смеси над жидкостью.
Математическое выражение закона:
с(Х) = kр(Х)
Влияние температуры:
С увеличением температуры, растворимость (абсорбция) газов уменьшается.
Влияние электролитов: Абсорбция газов в растворах электролитов подчиняется закону Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается вследствие высаливания газов.
Математическое выражение закона:
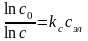 ,
,
Абсорбция происходит при газовом обмене в легких, при процессах питания живых клеток.
2 Вопрос) Адсорбция на неподвижной поверхности раздела фаз:
- Адсорбция газов и паров на твердых адсорбентах
- Адсорбция из растворов
- Адсорбция ионов из растворов - Ионообменная адсорбция
Твердые адсорбенты имеют поры различного размера.
адсорбенты |
пример |
непористые |
сахар, рис, пшено, гречка, некоторые сорта растворимого кофе |
макропористые |
мука, хлеб, сухари, макароны, пастила, зефир |
мезопористые |
минеральные адсорбенты |
микропористые |
активированный уголь |
Теория Ленгмюра, основные положения которой следующие:
- адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных (активных) центрах, где имеются участки с нескомпенсированными силовыми полями;
- каждый адсорбционный центр может удерживать только одну молекулу адсорбтива, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества;
- процесс адсорбции носит динамический характер, т.к. адсорбиро- ванные молекулы удерживаются адсорбционными центрами толь- ко в течение определенного промежутка времени, после чего про- исходит десорбция этих молекул и адсорбция того же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции:
Г
= Г
 ,
,
где Г – величина предельной адсорбции; с – равновесная концентрация адсорбтива в системе, - константа адсорбционного равновесия.
3 Вопрос) Адсорбция газов и паров на твердых адсорбентах (г/тв, ж/тв) является чисто поверхностным процессом, который заключается во взаимодействии молекул адсорбата (адсорбтива) с поверхностью адсорбента за счет сил Ван-дер-Ваальса и водородных связей. Количество поглощенного газа или пара твердым адсорбентом в результате адсорбции зависит от следующих факторов:
- природы и площади поверхности адсорбента;
- природы поглощаемого газа или пара;
- концентрации адсорбтива (газа или пара);
- температуры.
Адсорбция газов и паров на твердых адсорбентах зависит прежде всего от свободной поверхностной энергии, которая имеет большую величину для адсорбентов с аморфной структурой (активированный уголь) на выступах, впадинах и в капиллярах, а для кристаллических (оксиды кремния, алюминия) - на ребрах, углах и в трещинах кристаллов. Поэтому адсорбент тем эффективней, чем мельче измельчен и чем выше его пористость.
Адсорбируемость газа или пара определяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные – на неполярных адсорбентах. При этом, чем больше адсорбтив склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется.
4 Вопрос) Адсорбция из растворов, главное отличие от адсорбции газов – это конкуренция между растворенным веществом и растворителем за возможность адсорбироваться на поверхности твердого адсорбента.
Влияние концентрации растворенного вещества на процесс его адсорбции из раствора при постоянной температуре можно описать, используя уравнения Ленгмюра или Фрейндлиха.
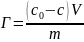
Адсорбция растворенных веществ твердыми адсорбентами подчиняется общему правилу:
Чем хуже данный растворитель смачивает поверхность адсорбента и хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Влияние природы поглощаемого вещества определяется несколькими правилами: Во-первых, правилом - подобное взаимодействует с подобным, которое указывает на необходимость сродства между адсорбируемым веществом и адсорбентом.
правилом Н.А. Шилова: Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
Это происходит из-за конкурентного характера молекулярной адсорбции из раствора, где концентрация растворителя всегда значительно больше, чем вещества в растворе. Поэтому из лиофильной системы, прежде всего, будет адсорбироваться растворитель, а не вещество.
Используется при лечении желудочно-кишечных отравлений, интоксикаций, вздутий.
5 Вопрос) Адсорбция ионов из растворов.
В зависимости от природы адсорбента процессы адсорбции ионов электролитов подразделяются на ионную адсорбцию и ионообменную адсорбцию.
Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах.
Ионная адсорбция имеет ряд характерных особенностей:
1. В результате ионной адсорбции на поверхности адсорбента за счет адсорбции потенциалопределяющих ионов возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы - противоионы, в результате на границе раздела фаз возникает двойной электрический слой.
2. Скорость ионной адсорбции меньше скорости молекулярной ад- сорбции.
3. Ионная адсорбция не всегда обратима.
4. Наблюдается неравенство адсорбции катионов и анионов, что зави- сит от природы адсорбента и природы иона (заряд, радиус, степень гидратации).
5. Если в растворе электролита имеются такие же ионы как и в составе твердого адсорбента, то ионная адсорбция принимает строго избирательный характер, описываемый правилом Панета-Фаянса- Пескова:
На поверхности кристалла преимущественно будут адсорбироваться те ионы, которые входят в состав кристаллической решетки адсорбента или изоморфны (сходны) им по строению.
Ионообменная адсорбция
Ионообменная адсорбция протекает только на тех адсорбентах, которые способны диссоциировать с поверхности, посылая в раствор катионы или анионы и образуя двойной электрический слой без участия ионов растворенного электролита.
Особенности ионообменной адсорбции:
1. Специфичность, т.е. данный адсорбент способен к обмену только определенных ионов;
2. Может быть необратимой;
3. Протекает более медленнее, чем молекулярная;
4. Может изменяться рН среды при обмене ионов Н+ или ОН–.
6 Вопрос) Хроматография – физико-химический метод разделения и анализа смесей веществ, основанный на повторяющихся процессах сорбции и десорбции разделяемых веществ между подвижной и неподвижной фазами.
Сущность хроматографии заключается в том, что через слой адсорбента, являющегося неподвижной фазой, пропускают поток элюента – жидкость или газ (подвижная фаза), содержащего разделяемую смесь. Так как различные вещества на одном и том же адсорбенте адсорбируется в разной степени, то при адсорбционном равновесии они разное время будут находиться на поверхности адсорбента. Вещество, имеющее большее сродство к адсорбенту, будет адсорбироваться первым, и будет дольше удерживаться на поверхности адсорбента. Вещество, имеющее слабое сродство к адсорбенту, будет адсорбироваться последним и слабо удерживаться на его поверхности. В результате этого смесь разделяется на зоны, каждая из которых преимущественно содержит чистое вещество.
С помощью хроматографии определяют аминокислоты, ферменты, гормоны, клетки, липиды, нуклеиновые кислоты, токсины, рецепторы.
7 Вопрос) (Не совсем понял вторую часть вопроса) В зависимости от агрегатного состояния подвижной фазы различают:
Газовая хроматография
Жидкостная хроматография
В газовой хроматографии подвижной фазой является газ, а неподвижной - твердое тело или жидкость. В соответствии с этим газовую хроматографию делят на газо-адсорбционную с твердым адсорбентом и газо-жидкостную. Жидкостную хроматографию делят на жидкостно-адсорбционную (неподвижная фаза-твердый адсорбент) и жидкостно-жидкостную. Жидкостная неподвижная фаза в газо-жидкостной и жидкостно-жидкостной хроматографии может быть образована путем закрепления жидкости в порах твердого инертного носителя.
8 Вопрос) По механизму процесса разделения различают следующие виды хроматографии: адсорбционная, распределительная, ионнообменная, молекулярноситовая (гель-хроматография), хемосорбционная.
Адсорбционная хроматография — вид хроматографии, при которой разделение веществ, входящих в смесь и движущихся в потоке подвижной фазы, происходит за счёт их различной способности адсорбироваться и десорбироваться на поверхности адсорбента с развитой поверхностью, например, силикагеля. Процесс взаимодействия может сопровождаться химическим взаимодействием примесей с неподвижной фазой, то есть хемосорбцией. Адсорбционная хроматография основана на различии в адсорбционных свойствах разделяемых веществ. Компоненты, не адсорбирующиеся стационарной фазой, будут во время анализа находиться только в подвижной фазе, скорость их перемещения вдоль стационарной фазы будет максимально возможной. Наоборот, хорошо адсорбирующиеся компоненты будут медленно передвигаться вдоль стационарной фазы.
Распределительная хроматография — хроматографический метод, при котором неподвижная (стационарная) фаза химически связана с поверхностью неподвижного носителя. Подвижной фазой является жидкость, которая служит растворителем, или газ (газовая хроматография). Разделение происходит за счёт различия полярности разделяемых веществ. Основана на различиях в коэффициентах распределений, представляющих собой отношение концентрации вещества в неподвижной фазе – жидкости – к концентрации вещества в подвижной фазе – газе или жмдкости.
С помощью хроматографии определяют аминокислоты, ферменты, гормоны, клетки, липиды, нуклеиновые кислоты, токсины, рецепторы.
9 Вопрос) По механизму процесса разделения различают следующие виды хроматографии: адсорбционная, распределительная, ионнообменная, молекулярно-ситовая (гель-хроматография), хемосорбционная.
Ионообменная хроматография основана на различной способности разделяемых ионов к ионному обмену с фиксированными ионами сорбента, образующимися в результате диссоциации ионогенных групп сорбента.
Молекулярно-ситовая (гель-хроматография) (ситовая хромато-графия). В отличие от распределительной хроматографии в гель-хроматографии подвижной и неподвижной фазами служит одна и та же жидкость-растворитель. Та часть жидкости, которая протекает вдоль слоя твердого носителя - зѐрен геля, выполняет функцию подвижной фазы и переносит компоненты смеси вдоль колонки. Другая часть этой же жидкости проникает в поры зѐрен геля и выполняет функцию неподвижной фазы.
Разделение смеси веществ в гель-хроматографии происходит, если размеры молекул этих веществ различны. При фильтровании раствора смеси веществ более мелкие молекулы, проникая в поры геля, задерживаются в растворителе, содержащемся в порах, и движутся вдоль слоя геля медленнее, чем крупные молекулы, не способные проникать в поры.
10 Вопрос) По технике выполнения различают:
Колоночную хроматографию
Плоскостную хроматографию
Плоскостная в свою очередь включает бумажную и тонкослойную хроматографию. Наиболее широко используется колоночная хроматография, в процессе которой разделение веществ происходит в узкой и длинной хроматографической колонке, заполненной адсорбентом. В бумажной хроматографии в качестве адсорбента используют специальную однородную бумагу, а в тонкослойной хроматографии применяют тонкие слои адсорбентов, нанесенные на пластинки из инертных материалов.
Бумажная хроматография основана на различии в скорости перемещения компонентов анализируемой смеси по бумаге в потоке растворителя. В бумажной хроматографии используют специальную бумагу, которая содержит только целлюлозные волокна.
Тонкослойная хроматография (ТСХ) основана на различии в скорости перемещения компонентов анализируемой смеси вдоль тонкого слоя сорбента в потоке растворителя.
11 Вопрос) К оптическим методам анализа относят физико-химические методы, основанные на взаимодействии электромагнитного излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения излучения, отражения и рассеяния электромагнитного излучения. Оптические методы включают в себя большую группу спектральных методов анализа.
Фотометрический анализ относится к абсорбционным методам, т.е. основан на измерении поглощения света веществом. Он включает спектрофотометрию, фотоколориметрию и визуальную фотометрию, которую обычно называют колориметрией.
Каждое вещество поглощает излучение с определенными (характерные только для него) длинами волн, т.е. длина волны поглощаемого излучения индивидуальна для каждого вещества, и на этом основан качественный анализ по светопоглошению.
12 Вопрос) Растворы электроли́тов — растворы или расплавы веществ, которые проводят электрический ток вследствие диссоциации на ионы, или движения ионов в кристаллических решётках твёрдых электролитов.
Электролитическая подвижность ионов (u) – это средняя скорость направленного движения ионов в растворе при напряженности электрического поля 1 В/м.
Величина электролитической подвижности ионов в растворах зависит от:
Природы иона: чем меньше истинный радиус иона, тем больше его эффективный радиус в растворе электролита, тем ниже подвижность. Степень гидратации будет тем больше, чем больше плотность заряда на поверхности иона электролита. Скорость движения многозарядных ионов мало отличается от скорости движения однозарядных, что обу- словлено большей степенью гидратации многозарядных вследствие большей плотности заряда на их поверхности.
Природы растворителя:
а) чем больше его полярность, тем больше степень гидратации, тем меньше электролитическая подвижность; б) чем больше вязкость среды, тем больше сопротивление движению иона, тем меньше подвижность.
Ионной силы раствора: чем больше ионная сила раствора, тем сильнее межионное взаимодействие, тем меньше подвижность.
Температуры раствора: с увеличением температуры уменьшается вяз- кость среды и степень сольватации (гидратации) в связи с чем увеличивается электролитическая подвижность.
Концентрации ионов. При повышении концентрации электролита увеличивается ионная сила раствора, и скорость движения ионов уменьшается за счет возрастающих межионных взаимодействий.
13 Вопрос) Удельная электрическая проводимость (каппа) – количество электричества, переносимое ионами, содержащимися в растворе, через поперечное сечение раствора площадью 1 м2, при напряженности однородного электрического поля 1 В,м за 1 с.
Удельная электрическая проводимость зависит от природы электро- лита, его концентрации (разведения), скорости движения ионов и температуры.
Чем выше заряд иона, тем большее количество электричества пере- носит данный ион соответствующему электроду.
Удельная электрическая проводимость имеет наибольшее значение в растворах сильных электролитов.
Вопрос 14) Молярная электрическая проводимость ( Лс) – это электрическая проводимость 1 моль электролита, находящегося в растворе между параллельными электродами с расстоянием между ними 1 м при напряженности электрического поля 1 В/м.
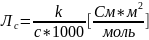
Молярная электрическая проводимость при разбавлении может только возрастать, так как при постоянном количестве растворенного вещества у слабых электролитов увеличивается общее число ионов за счет возрастания степени диссоциации (закон Оствальда), а у сильных электролитов за счет уменьшения межионного взаимодействия. При бесконечном разведении молярная электрическая проводимость перестает зависеть от концентрации и достигает максимального значения, называемого предельной молярной электрической проводимостью (Ло).
