
- •2. Азотистый баланс организма и его регуляция. Суточная потребность в белках. Биологическая ценность белков. Незаменимые аминокислоты
- •3.. Общие пути обмена аминокислот.
- •3.Декарбоксилирование, связанное с реакцией трансаминирования:
- •4.Декарбоксилирование, связанное с реакцией конденсации двух молекул:
- •4. Образование и обезвреживание аммиака в организме. Орнитиновый цикл синтеза мочевины. Его роль и связь с другими метаболическими путями.
- •5. Специфический обмен глицина и серина. Их роль в биосинтезе биологически важных веществ.
- •6. Специфический обмен фенилаланина и тирозина. Образование биологически активных продуктов. Молекулярная патология (фенилкетонурия, алкаптонурия, альбинизм).
- •7. Специфический обмен серосодержащих аминокислот. Их роль в биосинтезе биологически важных веществ.
- •8.Специфический обмен триптофана и гистидина. Образование и биологическая роль серотонина и гистамина.
- •9. Включение аминокислот в общие пути метаболизма. Гликогенные и кетогенные аминокислоты. Привести примеры.
- •10.. Молекулярная патология обмена аминокислот (фенилкетонурия, алкаптонурия, альбинизм, лейциноз).
- •11. Катаболизм гемоглобина. Образование и обмен билирубина. Дифференциальная диагностика желтух.
- •12. Катаболизм нуклеопротеинов. Патология пуринового обмена.
- •47. Химический состав крови. Характеристика буферных систем. Остаточный азот.
- •48.2. Белки крови. Общая характеристика, роль, отдельные представители. Электрофорез белков крови
- •49. Альбумин. Структура и функции.
- •51. Дыхательная функция крови. Гемоглобин и миоглобин. Структура, функции, особенности функционирования.
- •52.Роль печени в обмене углеводов
- •54.Роль печени в обмене белков
- •I.Окисление:
- •56.Участие печени в пигментном обмене. Виды желтух
7. Специфический обмен серосодержащих аминокислот. Их роль в биосинтезе биологически важных веществ.
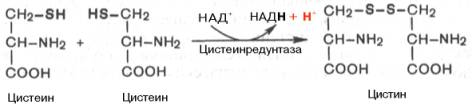
В молекулах белка обнаружены три серосодержащие аминокислоты (метионин, цистеин и цистин). Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином.
Многие ферменты содержат в активном центре SH-группы, необходимые для каталитической реакции. При их окислении ферменты теряют свою активность. Предполагают, что одной из главных функций глутатиона является сохранение этих ферментов в активной восстановленной форме. Окисленный глутатион может восстанавливаться под действием глутатионредуктазы, используя НАДФН. Глутатион может оказывать ингибирующее действие на некоторые белки. Например, инсулин под действием глутатионинсулинтрансгидрогеназы.
В процессе катаболизма сера метионина в тканях в основном переходит в серу цистеина, а взаимопревращение цистина в цистеин осуществляется легко. В окислении цистеина главным путем оказался окислительный, включающий окисление цистеина в цистеинсульфиновую кислоту, трансаминирование последней с α-кетоглутаратом и образование пирувата и сульфита по схеме:
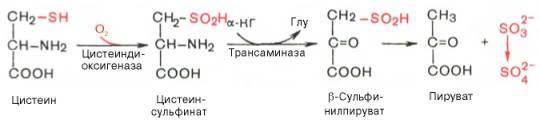
Сульфит затем быстро окисляется в тканях и выводится с мочой в виде нетоксичных сульфатов и эфиросерных кислот.
Превращение метионина в цистеин необратимый процесс. Углеродный скелет цистеина происходит из серина. Фактическим донором метильных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин – S-аденозилметионин, который образуется в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой.
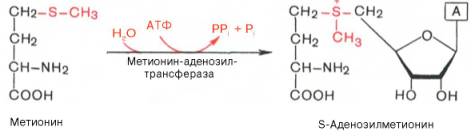
Своеобразие данной реакции заключается в том, что СН3-группа метионина активируется под действием положительного заряда соседнего атома серы. S-аденозилметионин участвует во всех реакциях, где метильная группа используется в биосинтетических реакциях: например, в синтезе адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Образовавшийся после отщепления метильной группы S-аденозилгомоцистеин подвергается гидролизу на аденозин и гомоцистеин; последний используется в синтезе серина (это основной путь превращения) или служит акцептором метильной группы от N5—СН3—ТГФК в синтезе метионина (эту реакцию катализирует гомоцистеинметилтрансфераза), завершая, таким образом, своеобразный цикл активирования метильной группы.

8.Специфический обмен триптофана и гистидина. Образование и биологическая роль серотонина и гистамина.
Триптофан-незаменимая для человека и животных аминокислота, т.к. это предшественник ряда важных биологически активных веществ, в частности серотонина и рибонуклеотида никотиновой кислоты. В физиологических условиях более 95% триптофана окисляется по кинурениновому пути и не более 1%-по серотониновому. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилуксусной кислоты, которая выделяется с мочой. Содержание этой кислоты в моче повышено при поражениях кишечника злокачественными карциноидами, когда около 60% триптофана окисляется по серотониновому пути. Основной путь обмена триптофана приводит к синтезу НАД, уменьшая потребность организма в витамине РР. Триптофан под действием гемсодержащего фермента триптофан-2,3-диоксигеназы в присутствии молекулярного кислорода превращается в формилкинуренин, который распадается при участим формамидазы (формилкинуреаиназы) на муравьиную кислоту и кинуренин; последний окисляется в 3-оксикинуренин. Дальнейшие превращения 3-оксикинуренина связаны с пиридоксалевым ферментом кииурениназой, гидролизующей его на аланин и 3-оксиантраниловую кислоту, которая через ряд промежуточных продуктов (механизм образования их до конца не раскрыт) превращается в хинолиновую кислоту, т. е. в непосредственный предшественник рибонуклеотида никотиновой кислоты.
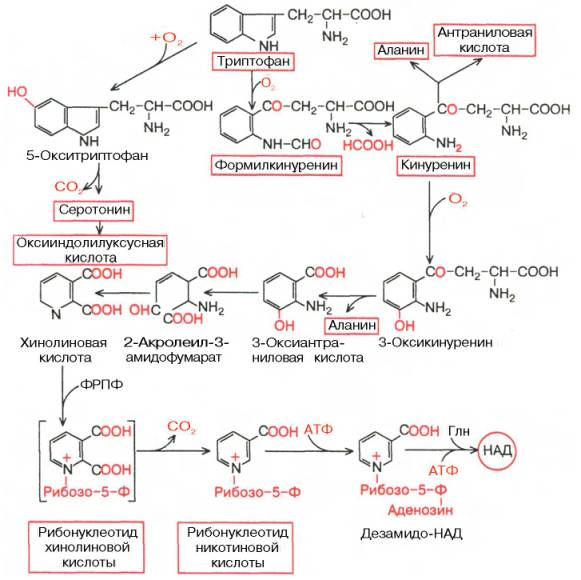
Метаболические превращения триптофана.
Гистидин- незаменимая аминокислота. Организм человека способен к ограниченному синтезу гистидина. Входит в состав активных центров многих ферментов, в частности рибонуклеазы, транскетолазы. Начальная стадия ферментативного разрушения гистидина в организме – отщепление аммиака с образованием уроканиновой кислоты, выводящейся с мочой. Реакция дезаминирования гистидина необратима, катализирует ее фермент гистидинаммиаклиаза (гистидиндезаминаза), обнаруженный в печени животных и у бактерий. Недостаток гистидина приводит ко многим нарушениям обмена веществ, т.ч. к торможению синтеза гемоглобина. Гистидин - предшественник специфических дипептидов скелетной мускулатуры - карнозина и анзерина. Декарбоксилирование гистидина ведет к образованию биологически активного амина - гистамина. Этот процесс катализирует гистидиндекарбоксилазафермент, относящийся к классу лиаз. Фермент действует только на L-изометр (природную форму) гистидина. Реакция обратимо тормозится ингибиторами дыхания - цианидом, гидроксиламином, семикарбазидом.
Образующийся из 5-окситриптофана, серотонин является высокоактивным биогенным амином сосудосуживающего действия. Серотонин регулирует артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастен к развитию аллергии, демпинг-синдрома, токсикоза беременных, карциноидного синдрома и геморрагических диатезов.
Гистамин обладает сосудорасширяющим свойством. Большое количество гистамина образуется в области воспаления. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. Кроме того, гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации. При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают также роль медиатора боли.
