
- •Предисловие
- •Тема 1. Растворы. Состав растворов
- •Варианты условий задач
- •Методика выполнения вариантов заданий
- •Решение
- •Тема 2. Коллигативные свойства растворов
- •Методика выполнения вариантов заданий
- •Решение
- •Тема 3. Электролиты. Гидролиз солей. Буферные растворы
- •Методика выполнения вариантов заданий
- •Решение
- •Тема 4. Коллоидные растворы
- •Свойства коллоидных растворов
- •Устойчивость коллоидных растворов
- •Коагуляция неорганических гидрозолей
- •Методика выполнения
- •Решение
- •Тема 5. Основы аналитической химии
- •Методика выполнения
- •Решение
- •Решение
- •Примерные варианты модулей Модуль. Растворы. Коллигативные свойства. Гидролиз солей
- •Модуль. Окислительно-восстановительные реакции. Комплексные соединения. Коллоидные растворы
- •213407, Г.Горки Могилевской обл., ул. Студенческая, 2
Методика выполнения вариантов заданий
На теоретические вопросы 1, 2 ответы подготовить по учебным пособиям и лекциям.
3. Напишите в ионной форме следующие уравнения:
AgNO3 + KI AgI↓ + KNO3;
Ag+ + NO3- + K+ + I- AgI↓ + K+ + NO3-;
Ag+ + I- AgI↓.
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: аммоний сульфата; калий силиката.
соль сульфат аммония (NH4)2SO4 образована слабым основанием и сильной кислотой. Гидролиз соли, образованной слабым основанием и сильной кислотой, сводится к гидролизу катиона слабого основания. В результате этого концентрация ионов Н+ в растворе становится больше концентрации ионов ОН- и раствор приобретает кислую реакцию (рН<7):
NH4+ + H2O ↔ NН4ОН + H+;
(NH4)2SO4 + 2Н2О ↔ 2NН4ОН+ H2SO4.
соль силикат калия K2SiO3образована сильным основанием и слабой кислотой. Гидролиз соли, образованной сильным основанием и слабой кислотой, сводится к гидролизу аниона слабой кислоты. Поэтому в растворе соли K2SiО3 концентрация ионов ОН- становится больше концентрации ионов Н+, и реакция этого раствора щелочная (рН>7):
1) SiO32- + H2O ↔ HSiO3- + ОН-
K2SiO3+Н2О ↔ KНSiO3 + КОН;
2) HSiO3- + H2O ↔ H2SiO3 + ОН-
KHSiO3+Н2О ↔ Н2SiO3 + KОН.
5. Задача. Вычислить рН буферного раствора, состоящего из 80 мл 0,15 М
раствора CH3COOH и 20 мл 0,1 М раствора CH3COONa.
Константа электролитической диссоциации уксусной кислоты равна 1,8510-5.
Решение
По
уравнению буферной смеси концентрация
водородных ионов в буферном растворе
определяется, как
[H+]=K![]() или
в других обозначениях
С(Н+)=К
или
в других обозначениях
С(Н+)=К![]() ,
,
где Скислоты – концентрация кислоты;
Ссоли– концентрация соли в приготовленной буферной смеси.
Концентрация кислоты и соли в смеси может быть рассчитана по данным задачи:
Скислоты=![]() =0,12;
Ссоли=
=0,12;
Ссоли=![]() =0,02
моль/л,
=0,02
моль/л,
где 80 и 20 – объемы кислоты и соли, взятые для приготовления буферного раствора, мл;
20+80 – общий объем раствора.
Полученные величины подставляются в уравнение буферной смеси:
С(Н+)=1,8510-5![]() =1.1110-4
моль/л.
=1.1110-4
моль/л.
Далее находим величину рН: рН= –lgC(H+),
pH= –lg(1.1110-4),
pH= –(lg1.11–4lg10)=4 – 0,045 = 3,955; pH=3,955.
Ответ: pH=3,955.
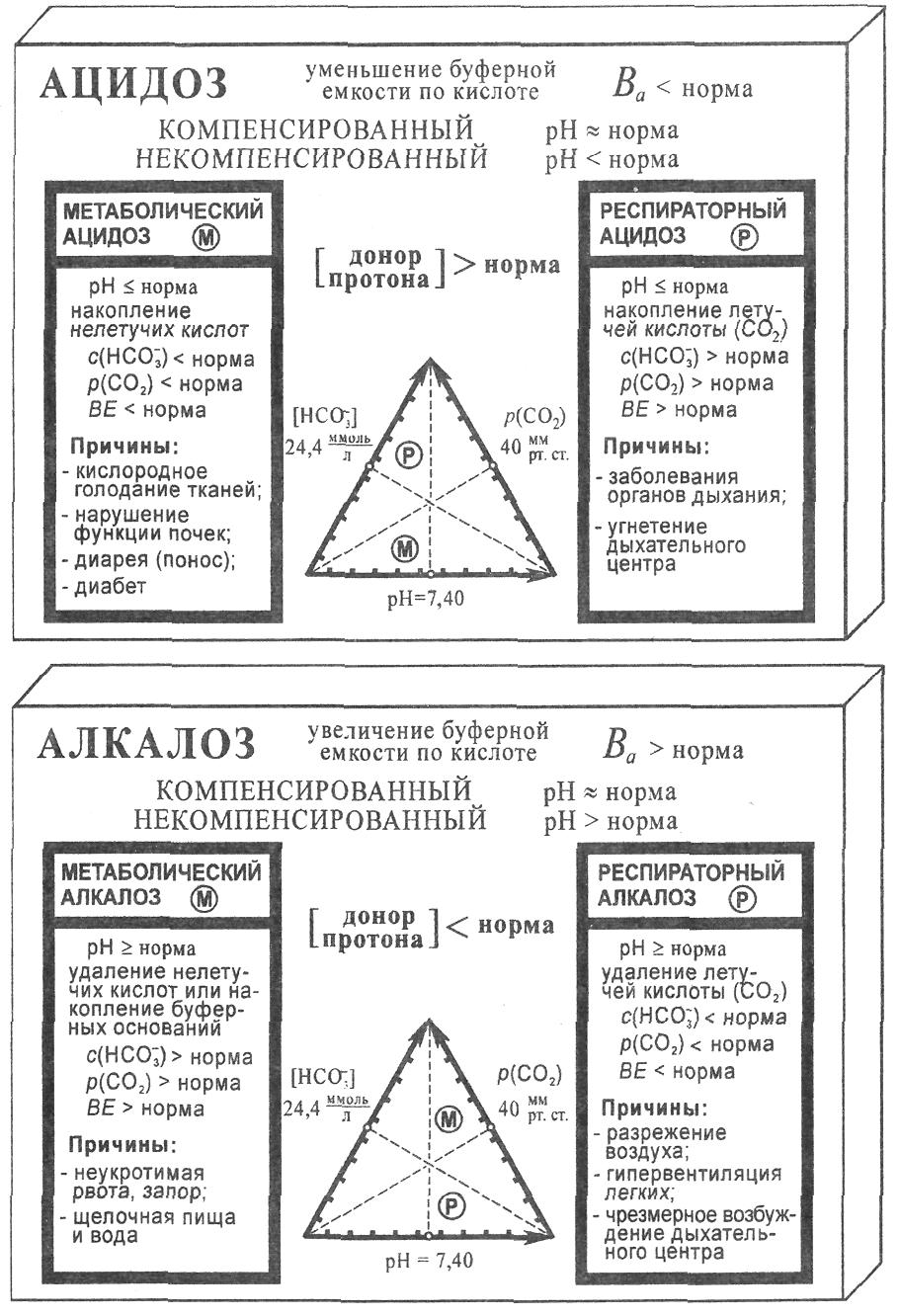
Рис. 1. Процессы ацидоза и алкалоза в биологических системах
В а р и а н т 1
1. Степень диссоциации и факторы, влияющие на нее. Типы электролитов.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
Pb(NO3)2 + CaI2
NH4Cl + NaOH
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) аммоний нитрата; б) натрий силиката; в) алюминий сульфида.
5. Рассчитать, в каком соотношении необходимо смешать 0,1н. раствор NH4OH c раствором NH4Cl, чтобы получить буферный раствор с рН=7,8. (Кд(NH4OH)=1,7910-5) .
В а р и а н т 2
1. Свойства электролитов. Теория электролитической диссоциации. Диссоциация электролитов с различным характером его химических связей. Гидратация ионов.
2. Буферные растворы: классификация, механизм их действия, буферная емкость.
3. Напишите в ионной форме следующие уравнения:
AgNO3 + AlBr3
Zn(OH)2 + HCl
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) алюминий нитрата; б) калий цианида; в) аммоний карбоната.
5. Определить рН буферного раствора, состоящего из 50 мл раствора KH2PO4 (в качестве кислоты) и 80 мл раствора K2HPO4 (в качестве соли) одинаковой концентрации (KH2PO4-=6,3·10-3).
В а р и а н т 3
1. Ионное равновесие. Образование осадка. Произведение растворимости.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
Ba(OH)2 + H2SO4
ZnS + HCl
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) магний хлорида; в) калий сульфида; в) хром (III) карбоната.
5. Определить рН буферного раствора, полученного смешиванием 200 мл 0,1 н. раствора NH4OH и 150 мл 0,1 н. раствора NH4Cl. (Кд(NH4OH)=1,7910-5.
В а р и а н т 4
1. Слабые электролиты. Константа диссоциации. Закон разведения Оствальда.
2. Понятие о кислотно-основном равновесии крови. Ацидоз, алкалоз. Роль электролитов в жизнедеятельности организмов.
3. Напишите в ионной форме следующие уравнения:
H2S + CuSO4
Al(OH)3 + NaOH
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) алюминий сульфата; б) натрий нитрита; в) аммоний цианида.
5. Вычислить рН буферной смеси, состоящей из 40 мл 0,2 н. CH3COOH и 20 мл 0,1 н. CH3COONa. (Кд(CH3COOH)=1,7510-5.
В а р и а н т 5
1. Ионное равновесие. Ионные уравнения.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
H2SO4 + NH4OH
CaCO3 + HCl
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) магний хлорида; б) калий сульфида; в) аммоний ацетата.
5. Какой объем в мл 0,2 н. NH4OH необходимо прибавить к 20 мл 0,1 н. NH4OH, чтобы полученная буферная смесь имела рН=9,16? (Кд(NH4OH)=1,7910-5).
В а р и а н т 6
1. Сильные электролиты в растворах. Кажущаяся степень диссоциации сильных электролитов.
2. Понятие о кислотно-основном равновесии крови. Электролиты в жизнедеятельности организмов.
3. Напишите в ионной форме следующие уравнения:
Pb(CH3COO)2 + Na2SO4
NaOH + AlCl3
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) алюминий хлорида; б) калий силиката; в) хром (III) сульфида.
5. Сколько миллилитров 0,1 н. раствора CH3COONa необходимо прибавить к 20 мл 0,5 н. раствора CH3COOH, чтобы получить буферную смесь с рН=5,65? (Кд(CH3COOH)=1,7510-5).
В а р и а н т 7
1. Ионное равновесие. Ионные уравнения. Образование осадка. Произведение растворимости.
2. Буферные растворы: классификация, механизм их действия, буферная емкость.
3. Напишите в ионной форме следующие уравнения:
Na2CO3 + HNO3
BaCl2 + Na2CrO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) аммоний нитрата; б) натрий сульфида; в) магний ацетата.
5. Вычислить рН буферного раствора, если в 3 л его содержится 52,5 г NH4OH и 16,2 г NH4Cl. (Кд(NH4OH)=1,7910-5).
В а р и а н т 8
1. Сильные электролиты и их состояние в растворах. Активность, коэффициент активности, ионная сила раствора.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
CuCl2 + NaOH
LiCl + Na3PO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) медь(II) сульфата; б) натрий карбоната; в) аммоний нитрата.
5. Вычислить, в каком соотношении необходимо смешать 0,05 н. раствор NH4OH и 0,025 н. раствор NH4Cl, чтобы получить буферный раствор с рН=8,15. (Кд(NH4OH)=1,7910-5.
В а р и а н т 9
1. Ионное равновесие. Ионные уравнения. Водородный показатель и способы его определения.
2. Буферные системы организма животных и рыб. Буферные растворы: классификация, механизм их действия, буферная емкость.
3. Напишите в ионной форме следующие уравнения:
Na2CO3 + CH3COOH
AlCl3 + AgNO3
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) олово(II) хлорида; б) кальций сульфида; в) железо (III) карбоната.
5. Вычислить рН буферного раствора, если в 5 л его содержится 30г CH3COOH и 41 г CH3COONa. (Кд(CH3COOH)=1,7510-5).
В а р и а н т 10
1. Свойства электролитов. Теория электролитической диссоциации. Гидратация ионов.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
(NH4)2SO4 + NaOH
Pb(NO3)2 + Na2S
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) железо (III) нитрата; б) натрий ацетата; в) аммоний сульфида.
5. Вычислить рН буферного раствора, если в 2л его растворено 23 г HCOOH и 21 г HCOOK. (Кд(HCOOH)=1,7710-4).
В а р и а н т 11
1. Типы электролитов. Слабые электролиты. Константа диссоциации. Закон разведения Оствальда.
2. Понятие о кислотно-основном равновесии крови. Ацидоз, алкалоз. Роль электролитов в жизнедеятельности организмов.
3. Напишите в ионной форме следующие уравнения:
Na2S + CuSO4
K2SiO3 + HCl
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) алюминий сульфата; б) калий нитрита; в) аммоний ацетата.
5. Вычислить рН 1 л буферного раствора, содержащего 70 г NH4OH и 107 г NH4Cl. (Кд(NH4OH)=1,7910-5).
В а р и а н т 12
Сильные электролиты и их состояние в растворах. Активность, коэффициент активности, ионная сила раствора.
Буферные растворы: классификация, механизм их действия, буферная емкость.
Напишите в ионной форме следующие уравнения:
CaCO3 + HNO3
Al(OH)3 + H2SO4
Написать уравнения гидролиза солей в молекулярном и ионном виде: а) бериллий нитрата; б) натрий ортофосфата; в) аммоний цианида.
Навеска массой в 3,4 г HCOOK растворена в 250 мл 0,1 н. раствора муравьиной кислоты. Вычислить рН полученного буферного раствора. (Кд(HCOOH)=1,7710-4).
В а р и а н т 13
1. Степень диссоциации и факторы, влияющие на нее. Типы электролитов.
2. Гидролиз солей. Степень и константа гидролиза. Среда растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
Pb(NO3)2 + Na2CrO4
LiOH + K3PO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) барий нитрита; б) натрий силиката; в) аммоний карбоната.
5. К 200 мл 0,10 н. раствора HCOOH прилили 15 мл 0,15 н. раствора HCOOK. Вычислить рН образовавшегося буферного раствора. (Кд(HCOOH)=1,7710-4).
В а р и а н т 14
1. Ионные уравнения. Ионное произведение воды. Водородный показатель и способы его определения.
2. Буферные растворы: классификация, механизм их действия, буферная емкость. Ацидоз, алкалоз.
3. Напишите в ионной форме следующие уравнения:
AgNO3 + Na3PO4
Cr(OH)3 + KOH
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) свинец(II) хлорида; б) натрий нитрита; в) алюминий сульфида.
5. Сколько мл 0,2 н. раствора NH4OH необходимо добавить к 100 мл 0,4 н. раствора NH4NO3, чтобы получить буферный раствор с рН=8,35? (Кд(NH4OH)=1,7910-5).
В а р и а н т 15
1. Свойства электролитов. Теория электролитической диссоциации. Диссоциация электролитов с различным характером его химических связей.
2. Гидролиз солей. Степень и константа гидролиза. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
HNO3 + CaCO3
Al2(SO4)3 + NaOH
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) алюминий перманганата; б) натрий нитрита; в) алюминий сульфида.
5. К 400 мл 0,10 н. раствора CH3COOH прибавили 3,28 г безводного CH3COONa. Вычислить рН полученного буферного раствора CH3COOH. (Кд(СH3COOH)=1,7910-5).
В а р и а н т 16
1. Слабые электролиты. Константа диссоциации. Закон разведения Оствальда.
2. Буферные растворы: классификация. буферная емкость.
3. Напишите в ионной форме следующие уравнения:
CuSO4 + NaOH
LiF+ K3PO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) магний нитрата; б) цезий силиката; в) аммоний карбоната.
5. Вычислить рН 1 л буферного раствора, содержащего 35г NH4OH и 21,4 г NH4Cl. (Кд(NH4OH)=1,7910-5).
В а р и а н т 17
1. Ионное произведение воды. Водородный показатель и способы его определения.
2. Понятие о кислотно-основном равновесии крови. Ацидоз, алкалоз.
3. Напишите в ионной форме следующие уравнения:
FeCl2 + Ca(OH)2
BaCl2 + Na3AsO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) барий цианида; б) натрий гидрофосфата; в) аммоний нитрата.
5. К 500 мл 0,10 н. раствора HCOOH прилили 150 мл 0,2 н. раствора HCOOK. Вычислить рН образовавшегося буферного раствора. (Кд(HCOOH)=1,7710-4).
В а р и а н т 18
1. Степень диссоциации и факторы, влияющие на нее. Типы электролитов.
2. Буферные растворы: классификация, механизм их действия, буферная емкость. Ацидоз, алкалоз.
3. Напишите в ионной форме следующие уравнения:
Cr(NO3)2 + NH4OH
PbCl2 + Na2SO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) серебро(I) нитрата; б) натрий сульфита; в) алюминий карбоната.
5. Вычислить рН буферного раствора, если в 5 л его содержится 150г CH3COOH и 162 г CH3COONa. (Кд(CH3COOH)=1,7510-5).
В а р и а н т 19
1. Ионные уравнения. Образование осадка. Произведение растворимости.
2. Гидролиз солей. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
MgCl2 + KOH
AgNO3 + Na2CrO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) магний иодида; б) калий силиката; в) аммоний сульфида.
5. К 100 мл 0,1 н. раствора HCOOH прилили 300 мл 0,2 н. раствора HCOOK. Вычислить рН образовавшегося буферного раствора. (Кд(HCOOH)=1,7710-4).
В а р и а н т 20
1. Теория электролитической диссоциации. Диссоциация электролитов с различным характером его химических связей.
2. Гидролиз солей. Степень и константа гидролиза.
3. Напишите в ионной форме следующие уравнения:
ZnCl2 + NH4OH
AgNO3 + H3PO4
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) барий нитрита; б) натрий сульфида; в) магний ацетата.
5. Вычислить рН 2 л буферного раствора, содержащего 140 г NH4OH и 214 г NH4Cl. (Кд(NH4OH)=1,7910-5).
