
- •2. Классификация дисперсных систем
- •4. Зависимость поверхностного натяжения
- •5. Поверхностно-активные вещества
- •6. Пав и пиав
- •8. Поверхностная активность пав
- •9. Смачивание
- •10. Анализ уравнения Юнга
- •11. Адсорбция
- •13. Анализ ур-я Гиббса
- •16. Построение изотермы адсорбуии по изотерме пн
- •17. Уравнение Ленгмюра.
- •18. Аналитическое и графическое определение предельное адсорбции по уравнениям Гиббса и Ленгмюра.
- •20. Уравнение Фрейндлиха
- •21. Электрокинетические явления
- •22.Причины возникновения заряда на поверхности дисперсных частиц.
- •24.Теории строения двойного электрического слоя,их общность и различия.
- •25. Теория строения дэс Штерна
- •28.Получение коллоидных систем мотодом конденсации.Механизм конденсации.
- •29. Получение кс методом конденсации.
- •30.Строение мицелл гидрофобных золей.Правило Фаянса -Панета.
- •31. Формулы мицелл
- •34.Устойчивость коллоидных систем.Причины термодинамической неустойчивости коллоидных систем.
- •36. Агрегативная устойчивость коллоидных систем и ее количественная характеристика.
- •37. Факторы стабилизации дисперсных систем.
- •38.Коагуляция золей.Виды коагуляции.Факторы ,вызывающие коагуляцию.
- •39. Коагуляция золей.
- •40. Теория коагуляции Фрейндлиха
- •41. Электростатическая теория коагуляции Мюллера:
- •42. Теория длфо – физическая теория коагуляции
- •43.Лиофильные дисперсные системы на основе пав.Условия их получения.
- •44.Образование и строение мицелл пав.МицеллыГартли,мицеллы Мак-Бена.
- •45.Критическая концентрация мицеллообразования.Методы ее образования.
- •46. Моющие действия.
11. Адсорбция
увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции – десорбция
Классификация адсорбционных процессов
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие: Сорбция « Десорбция .
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
C + CH 3COOH « С × CH 3COOH .
адсорбен т адсорбтив комплекс
При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются
полярные вещества, на неполярных – неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8-40 кДж/моль, т.е. соизмерима с теплотой конденсации. dГi
4. С повышением температуры адсорбция уменьшается: dT < 0,
так как увеличивается скорость десорбции
12. Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
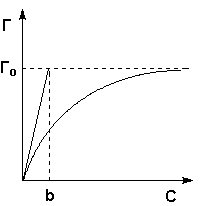
![]()
изотерма мономолекулярной адсорбции, связывающая величину адсорбции с концентрацией адсорбата .
Уравнение Фрейндлиха
при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
![]()
![]()
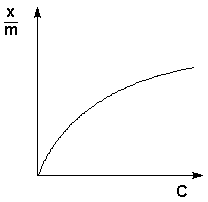
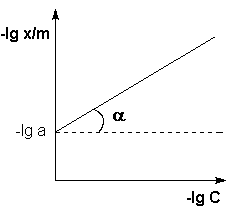
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения
![]()
![]()
Т.о.,
зависимость логарифма удельной адсорбции
от логарифма концентрации (давления)
графически выражается прямой линией,
отсекающей на оси ординат отрезок,
равный lga, тангенс угла наклона которой
к оси абсцисс равен по величине показателю
степени при давлении или концентрации
![]()
Уравение Гиббса
