
- •2. Классификация дисперсных систем
- •4. Зависимость поверхностного натяжения
- •5. Поверхностно-активные вещества
- •6. Пав и пиав
- •8. Поверхностная активность пав
- •9. Смачивание
- •10. Анализ уравнения Юнга
- •11. Адсорбция
- •13. Анализ ур-я Гиббса
- •16. Построение изотермы адсорбуии по изотерме пн
- •17. Уравнение Ленгмюра.
- •18. Аналитическое и графическое определение предельное адсорбции по уравнениям Гиббса и Ленгмюра.
- •20. Уравнение Фрейндлиха
- •21. Электрокинетические явления
- •22.Причины возникновения заряда на поверхности дисперсных частиц.
- •24.Теории строения двойного электрического слоя,их общность и различия.
- •25. Теория строения дэс Штерна
- •28.Получение коллоидных систем мотодом конденсации.Механизм конденсации.
- •29. Получение кс методом конденсации.
- •30.Строение мицелл гидрофобных золей.Правило Фаянса -Панета.
- •31. Формулы мицелл
- •34.Устойчивость коллоидных систем.Причины термодинамической неустойчивости коллоидных систем.
- •36. Агрегативная устойчивость коллоидных систем и ее количественная характеристика.
- •37. Факторы стабилизации дисперсных систем.
- •38.Коагуляция золей.Виды коагуляции.Факторы ,вызывающие коагуляцию.
- •39. Коагуляция золей.
- •40. Теория коагуляции Фрейндлиха
- •41. Электростатическая теория коагуляции Мюллера:
- •42. Теория длфо – физическая теория коагуляции
- •43.Лиофильные дисперсные системы на основе пав.Условия их получения.
- •44.Образование и строение мицелл пав.МицеллыГартли,мицеллы Мак-Бена.
- •45.Критическая концентрация мицеллообразования.Методы ее образования.
- •46. Моющие действия.
6. Пав и пиав
ПАВ(поверхностно-активные вещества) — вещества,
понижающие поверхностное натяжение водных растворов.
σПАВ σН2О
Неионогенные ПАВ — спирты, альдегиды, кетоны, сложные
эфиры.
Ионогенные ПАВ — органические кислоты, амины и их соли.
СН3 СОО-
СН3 NH3+
ПИВ (поверхностно-инактивные вещества) — вещества,
повышающие поверхностное натяжение водных растворов. Сильные
неорганические электролиты — соли, кислоты, щелочи.
σПИВ σН2О
7. Ур-е Шишковского
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации описывается эмпирическим уравнением Шишковского:
![]()
Здесь b и K – эмпирические постоянные, причём значение b одинаково для всего гомологического ряда, а величина К увеличивается для каждого последующего члена ряда в 3 – 3,5 раза.
8. Поверхностная активность пав
Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю.
Правило Дюкло-Траубе
Дюкло и Траубе сформулировали эмпирическое правило: в гомологическом ряду поверхностно-активных веществ поверхностная активность и адсорбция возрастают при переходе к каждому последующему члену гомологического ряда примерно в 3,2 раза. Однако это правило справедливо только для весьма разбавленных растворов и исключает три первых члена гомологического ряда. Математически это правило может быть записано
![]() или
или
![]()
Где
n – число атомов углерода в углеводородной
цепочке;
![]()
9. Смачивание
это поверхностное явление, заключающееся во взаимодействии жидкости с поверхностью твёрдого тела или другой жидкостью при условии, что присутствует третья (обычно, но не обязательно, газовая) фаза, причём происходит одновременный контакт всех этих трёх не смешивающихся фаз. Смачивание ответственно за растекание жидкости по твёрдой поверхности, за форму лежащих на ней капель, за пропитывание порошков и пористых веществ (капиллярные явления) и др.
Смачивание бывает двух видов:
Иммерсионное (вся поверхность твёрдого тела контактирует с жидкостью)
Контактное (состоит из 3х фаз-твердая, жидкая, газообразная)
10. Анализ уравнения Юнга
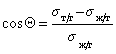 показывает, что
угол смачивания при отекании в этом
случае будет меньше угла натекания.
показывает, что
угол смачивания при отекании в этом
случае будет меньше угла натекания.
Тщательная предварительная очистка поверхности твердого тела в значительной степени исключает гистерезис смачивания, особенно если твердое тело нерастворимо в жидкости и имеет гладкую поверхность.
Вторая причина гистерезиса – шероховатость твердого тела, влияние которой на величину краевого угла смачивания мы обсудили выше. Поскольку углы натекания чаще бывают тупыми (Qн > 90o), а углы отекания острыми (Qо< 90o), то шероховатость увеличивает угол натекания и снижает угол отекания. Отметим, что шероховатость должна быть соизмерима с размером капли, иначе ее влияние будет незначительным. Практически все поверхности шероховаты на микроскопическом уровне, но такой вид шероховатости не оказывает влияния на смачивание. При макроскопической шероховатости возможно запирание пузырьков воздуха и поверхность твердого тела ведет себя как составная, что резко повышает величину углов натекания.
Третья
причина состоит в подвижности (или
неподвижности) поверхности твердого
тела в макроскопическом масштабе. Если
поверхность способна деформироваться
под действием молекулярных сил притяжения
и по периметру смачивания формируется
валик, этот валик способен оказывать
такое же влияние на угол смачивания,
как и шероховатость, рис. 1.27.
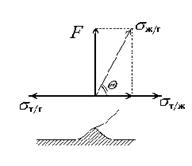
Образование валика происходит под действием нескомпенсированной нормальной составляющей силы поверхности .
Такая деформация видна невооруженным глазом на свежих набухших полимерных пленках, например на геле желатина. При перемещении фронта смачивания происходит смещение волны поверхностной деформации. Такой фактор вполне может проявляться и при смачивании полимерных волокон, особенно эластичных.
