
16.7.2. Микобактерии (семейство Mycobacteriaceae) Зверев
Микобактерии относятся к семейству Mycobacteriaceae порядка Actinomycetales роду Mycobacterium (от греч. myces — гриб и bacteria — палочка), в состав которого входит более 160 видов микобактерий.
Большинство видов микобактерий относят к сапрофитным микроорганизмам, широко распространённым в окружающей среде. Группа облигатных паразитов незначительна, её практическая значимость определяется видами, вызывающими туберкулёз у человека и животных.
Являются возбудителями микобактериальных заболеваний: туберкулеза, лепры, язвы Бурули и микобактериозов.
Это полиморфные микроорганизмы, образующие прямые или слегка изогнутые наточки размером 0,2—0,7x1—10 мкм, иногда ветвящиеся; возможно образование нитей наподобие мицелия, легко распадающихся на палочки или кокки. Родовой признак микобактерий — кислото-, спирто- и щелочеустойчивость, что обусловлено наличием большого количества липидов в клеточной стенке, содержащих миколовую кислоту; плохо воспринимают анилиновые красители, по Граму окрашиваются с трудом, обычно слабограмположительны.
Для их выявления применяют окраску кислото-, спирто- и щелочеустойчивых бактерий по Цилю—Нельсену, в основу которой положен принцип термокислотного протравливания. В препаратах микобактерии обнаруживаются в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями из 2—3 клеток в виде римской цифры пять.
Неподвижные, спор и капсул не образуют, аэробы и хемоорганогрофы. Растут медленно или очень медленно. Каталазо- и арилсульфогазоположительные, устойчивы к лизоциму.
Морфология и тинкториальные свойства. Особенности культивирования. Возбудители туберкулеза характеризуются выраженным полиморфизмом. Они имеют форму длинных, тонких (М. tuberculosis, М. africanum) или более коротких толстых (М. bovis) прямых или слегка изогнутых палочек с гомогенной или зернистой цитоплазмой, содержащей от 2 до 12 зерен различной величины, состоящих из липидов или метафосфатов и играющих важную роль в клеточном метаболизме бактерий. Зернистость у М. bovis менее выражена.
Полиморфизм возбудителей туберкулеза проявляется в образовании различных морфоваров: фильтрующихся и ультрамелких, зернистых и кокковидных, нитевидных, а также L-форм бактерий, которые обладают низкой метаболической активностью и длительно персистируют в макроорганизме внутриклеточно в макрофагах. Они нечувствительны к противотуберкулезным препаратам. Реверсия этих дремлющих форм в вирулентные бациллярные формы ведет к возникновению рецидивов и обострению заболевания.
М. tuberculosis относится к строгим аэробам. Они размножаются крайне медленно, требовательны к питательным средам, глицеринозависимые. Им нужны факторы роста: витамины группы В, аспарагиновая и глютаминовая аминокислоты. Стимулятором их роста является лецитин. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь, сыворотки животных и альбумин. Для подавления роста сопутствующей микрофлоры к средам добавляют красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Оптимальная температура культивирования 37—38 °С. Наилучший рост отмечается при pH 6,8—7,2.
К М. tuberculosis наибольшей восприимчивостью обладают морские свинки.
М. bovis — микроаэрофилы, растут на средах медленнее, чем М. tuberculosis, пируватзависимые. Высокопатогенны для кроликов.
М. africanum малопатогенны, выделяются от больных туберкулезом людей в тропической Африке.
При внутриклеточном размножении, а также при росте на жидких питательных средах или микрокультивировании через 48-72 ч у вирулентных штаммов выявляется корд-фактор (от англ. cord - жгут, веревка), благодаря которому микобактерии склеиваются и растут в виде переплетенных кос или жгутов.
Авирулентные штаммы возбудителей туберкулеза и нетуберкулезные микобактерии при микрокультивировании не образуют корд-фактора и растут беспорядочно. В отличие от возбудителей туберкулеза, растущих в культуре клеток HeLa в виде кос, условно-патогенные микобактерии дают ветвистый рост, а сапрофитные не размножаются.
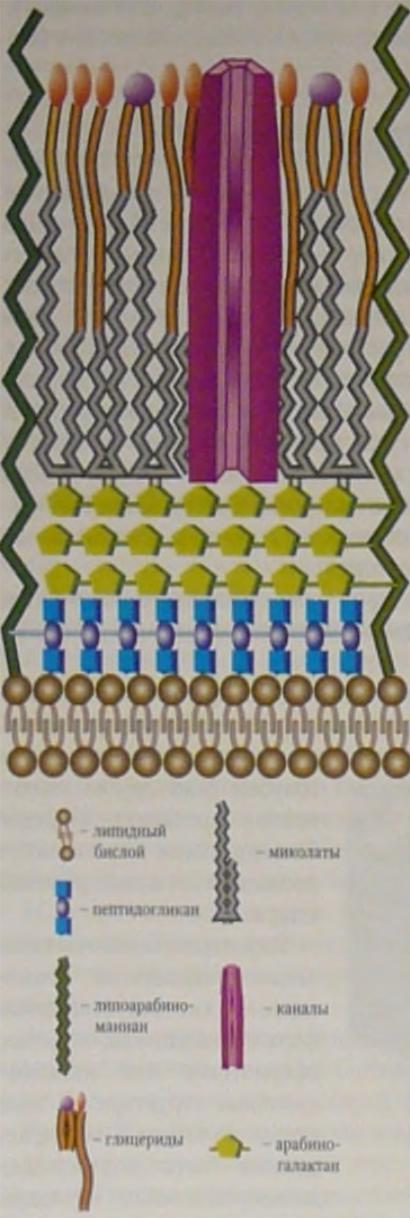
Клеточная стенка микобактерий имеет сложное строение. Первичный каркас клеточной стенки образуют перекрестно связанные пептидогликаны. Его дублирует слой арабиногалактанов, формирующий полисахаридную строму клетки, характеризующуюся относительно постоянным составом. Он имеет точки связывания с пептидогликаном, а также миколовыми кислотами и их производными.
Наружные слои представлены в основном липидами и имеют меняющийся химический состав.
Миколовые кислоты присутствуют в виде свободных сульфолипидов и корд-фактора, благодаря которому они растут в виде кос или жгутов. Корд-фактор — гликолипид, состоящий из трегалозы и димиколата, относится к факторам патогенности микобактерий. Уникальность миколовых кислот делает их мишенью для химиопрепаратов.
Поверхностный слой гликолипидов называют микозидами и иногда сравнивают с микрокапсулой. Это видоспецифические соединения, определяющие антигенные свойства микобактерий. Микозиды структурно и функционально напоминают липополисахариды наружной мембраны грамотрицательных бактерий, но лишены их агрессивности, тем не менее они токсичны и (подобно корд- фактору и сульфолипидам) вызывают образование гранулём.
Важным компонентом клеточной стенки является липоарабиноманан. Он заякорен на плазматической мембране, пронизывает клеточную стенку и выходит на ее поверхность. В этом отношении он похож на липотейхоевые кислоты грамположительных бактерий или липополисахаридный О-антиген грамотрицательных бактерий. Его терминальные фрагменты, а именно маннозные радикалы, подавляют активацию Т-лимфоцитов и лейкоцитов периферической крови, что ведет к нарушению иммунного ответа на микобактерии.
Клеточная мембрана и слои клеточной оболочки пронизаны каналами или порами, среди которых можно выделить пассивные поры с малым временем жизни, обеспечивающие управляемую диффузию веществ, и каналы с более длительным временем жизни, обеспечивающие энергозависимый транспорт веществ.
Химический состав, антигенная структура и факторы патогенности.
Основными химическими компонентами микобактерий являются белки (туберкулопротеины), углеводы и липиды. К ним образуются антифосфатидные, антипротеиновые и антиполисахаридные антитела, определение которых свидетельствует об активности инфекционного процесса и имеет прогностическое значение.
Туберкулопротеины составляют 56% сухой массы вещества микробной клетки. Они:
- являются основными носителями антигенных свойств микобактерий,
- высокотоксичны,
- вызывают развитие реакции гиперчувствительности IV типа.
На долю полисахаридов приходится 15% сухой массы вещества микобактерий. Это родоспецифические гаптены.
Липиды клеточной стенки, составляющие от 10 до 60% сухой массы клетки, определяют нестандартность тинкториальных, физиологических и экологических свойств микобактерий. Вирулентные микобактерии содержат липидов больше, чем кислотоустойчивые сапрофиты.
Основные патогенные свойства возбудителей туберкулеза обусловлены прямым или иммунологически опосредованным действием липидов и их комплексов с туберкулопротеинами и полисахаридами.
Описанные к настоящему времени специфические липиды микобактерий по структурным признакам делят на 7 основных групп:
1) жирнокислотные производные углеводов (главным образом, трегалозы - корд- фактор):
2) маннозиды фосфатидилмиоинозита:
3) жирнокислотные производные пептидов;
4) гликозиды N-ацилпептидов - микозиды С;
5) жирнокислотные эфиры фтиоцеролов;
6) микозиды А, В. G;
7) миколаты глицерина.
Липиды групп 4-6 найдены только в микобактериях.
Среди уникальных следует отметить туберкулостеариновую и туберкулопальмитиновую кислоты, являющиеся предшественниками миколовых кислот.
Миколовые кислоты — группа высокомолекулярных жирных кислот с длиной цепи до 84 углеродных атомов, структура основной цепи которых определяется систематическим положением микроорганизма и условиями его роста. Их низкая реакционная способность обеспечивает высокую химическую устойчивость клеточной стенки микобактерий. Миколаты подавляют ферментное расщепление клеточной стенки и свободнорадикальные реакции.
Корд-фактор относят к 1-й группе липидов. С ним связывают высокую токсичность микобактерий и вирулентность.
Поверхностно-активные липиды, или сульфолипиды, играют важную роль во внутриклеточной адаптации микобактерий. Вместе с корд-фактором они образуют цитотоксические мембранотропные комплексы.
Липоарабиноманнан представляет собой гетерогенную смесь высокомолекулярных липополисахаридов: разветвлённые полимеры арабинозы и маннозы с диацилглицериновыми производными пальмитиновой и туберкулостеариновой кислот.
Микозиды С представляют собой пептидогликолипиды. образующие внешнюю оболочку микобактерий. Микозиды — видоспецифичные соединения, от их типа зависят антигенные свойства микобактерий.
Количественный и качественный состав липидных соединений микобактерий имеет динамичный характер и зависит от возраста клеток, состава питательных сред, физико-химических характеристик окружающей среды. Молодые клетки микобактерий начинают формировать клеточную стенку с синтеза липополисахаридов с относительно короткими алифатическими цепями. На этой стадии они достаточно уязвимы и доступны для иммунной системы. По мере наращивания клеточной стенки и формирования высокомолекулярных липидов микобактерии приобретают устойчивость и индифферентность во взаимоотношениях с иммунной системой. Эти медленно размножающиеся, «бронированные» микробы поражают долгоживущие клетки — макрофаги. Они обладают способностью подавлять фагоцитоз. Микроб чаще всего выбирает макрофаги легких, обладающих низкой микробоидной активностью.
Локализация микобактерии туберкулёза внутри макрофагов обеспечивает, достаточную субстратную стабильность, учитывая «долгожительство» мононуклеарных фагоцитов и длительность репликации микобактерий, а также изоляцию от эффекторов гуморального иммунитета. В то же время возбудитель выбирает биотоп, который из-за потенциальной опасности неприемлем для большинства микроорганизмов. Этот симбиоз обеспечивается целым рядом приспособительных механизмов микобактерий.
Процесс поражения макрофага и паразитирования в нем выглядит следующим образом:
-проникновение микобактерий в макрофаг без его активации;
-подавление образования фаголизосом или трансформация их в зону, комфортную для бактерий;
-прорыв из фагосом в цитоплазму с инактивацией антимикробных факторов;
- вмешательство в жизнедеятельность клетки;
- ослабление чувствительности макрофагов к активирующим сигналам Т-лимфоцитов;
- снижение антигенпредставляющей функции макрофагов и сопряжённое с этим ослабление реакций цитотоксических Т-лимфоцитов, настроенных на уничтожение заражённых клеток.
При первом контакте с микобактериями иммунные системы макроорганизма не способны подключить гуморальный иммунитет, быстро обезвредить и элиминировать клетку из организма, так как подвижные алифатические цепи микобактериальной стенки не дают возможности провести оценку поверхностных структур возбудителя и передать соответствующую информацию для синтеза необходимого набора антител.
Высокая гидрофобность микобактерий обеспечивает неспецифические, т.е. независимые от рецепторов, контакты с макрофагами. Образуя вокруг клетки микобактерии фагосому, макрофаг помещает её внутри себя. Поверхностные микозидные и липоарабиноманнановые комплексы могут распознаваться рецепторами, однако запускаемые через них сигналы не активируют или слабо активируют макрофаги. Вследствие этого фагоцитоз не сопровождается выделением свободнорадикальных форм кислорода и азота. Считают, что в большей степени это характерно для вирулентных штаммов М. tuberculosis, которые благодаря структурным особенностям липоарабиноманнана, инициируют «неагрессивный» фагоцитоз. В распознавании М. tuberculosis принимают участие и другие рецепторы макрофагов, в частности CD 14 и рецепторы СЗ-компонента комплемента (CR1-CR3).
Проникнув внутрь макрофага, микобактерия включает ряд механизмов, препятствующих образованию фаголизосомы: продуцирование аммония, который защелачивает среду внутри фагосомы, синтез сульфолипидов, ведущий к формированию отрицательного заряда на поверхности фагосомы. что препятствует слиянию фагосомы и лизосомы.
Если всё же фаголизосома образовалась, микобактерия благодаря мощной восковой оболочке способна погасить свободнорадикальные реакции, вызываемые бактерицидными веществами фагоцитов. Аммоний защелачивает среду, блокируя активность лизосомальных ферментов, а сульфолипиды нейтрализуют мембранотропные катионные белки. Кроме того, микобактерии туберкулёза продуцируют высокоактивные ферменты с каталазной и пероксидазной активностью, которые конкурируют с перок- сидазными системами макрофагов, и одновременно инактивируют гидропероксиды лизосом.
Дальнейшая адаптация микобактерий состоит в использовании железосодержащих соединении макрофагов для своих ферментных систем и блокирования иммуноспецифических функций макрофагов. Макрофаги являются одним из главных резервуаров железа, избыток которого накапливается в виде ферритина. Содержание железа в альвеолярных макрофагах в 100 раз выше, чем в моноцитах крови, что, безусловно, содействует их колонизации микобактериями туберкулёза.
Токсическое действие на макрофаги микобактерии осуществляют посредством эндотоксинов и неспецифических факторов. И те, и другие поражают в первую очередь дыхательную систему макрофагов - митохондрии.
К эндотоксинам относят миколовые арабинолипиды, которые угнетают дыхание митохондрий.
К неспецифическим токсинам относят продукты синтеза липидной части клетки микобактерии - фтиеновые и фтионовые кислоты, которые вызывают разобщение окислительного фосфорилирования. Усиление метаболических процессов в этих условиях не сопровождается должным синтезом АТФ. Клетки хозяина начинают испытывать энергетический голод, что приводит к угнетению их жизнедеятельности, а в дальнейшем к цитолизу и апоптозу.
Не исключено, что некоторые факторы патогенности образуются только внутри заражённых клеток, как это происходит у других бактерий, предпочитающих внутриклеточный образ жизни. Например, сальмонеллы, паразитируя внутри макрофагов, дополнительно экспрессируют более 30 генов.
Устойчивость в окружающей среде.
Во-первых, благодаря наличию липидов микобактерии обладают гидрофобной клеточной стенкой, что делает их более устойчивыми в окружающей среде к действию неблагоприятных факторов, чем другие неспорообразуюшие бактерии.
Во-вторых, это обширные метаболические возможности. Они способны инактивировать многие клеточные токсины и вещества (различные перекиси, альдегиды и другие), разрушающие клеточную оболочку.
В-третьих, это морфологическая пластичность, заключающаяся в трансформации микобактерий (образование L-форм, дормантных клеток). По своей устойчивости, после спорообразующих бактерий, они занимают лидирующее место в царстве прокариот.
Высушивание мало влияет на их жизнеспособность в патологическом материале (мокроте и др.). Возбудитель сохраняет свою жизнеспособность в сухом состоянии до 3 лет.
Возбудители туберкулеза устойчивы к органическим и неорганическим кислотам, щелочам, многим окислителям и некоторым антисептикам, губительно действующим на другие патогенные бактерии. Они устойчивы к действию спиртов и ацетона.
Облученная солнечным светом культура микроорганизмов погибает в течение 1,5 ч, а под воздействием УФ-лучей — через 2—3 мин, поэтому распространение инфекции редко происходит вне помещения в дневное время, а наиболее действенными мерами, позволяющими снизить степень инфицированности того или иного помещения, являются адекватная вентиляция и воздействие УФ-лучей. Однако в реальных условиях, когда микобактерии туберкулёза находятся во взвешенном состоянии в виде клеточных агломератов с пылевыми частицами, их устойчивость к ультрафиолетовому излучению возрастает.
Отмечено, что средства на основе четвертичного аммония не проявляют противотуберкулезной активности. В определенных условиях концентрации радикалов хлора и кислорода до 0,5% также не оказывают губительного действия на микобактерии туберкулёза. Это подразумевает невозможность использования подобных средств для стерилизации мокроты и других инфицированных биологических материалов.
Микобактерии туберкулёза нечувствительны к рассеянному солнечному свету и могут более года существовать во внешней среде без потери жизнеспособности.
При кипячении они погибают через 5 мин, а при пастеризации — в течение 30 мин.
Для дезинфекции используют активированные растворы хлорамина и хлорной извести, вызывающие гибель возбудителей туберкулеза в течение 3—5 ч.
ТАКСОНОМИЯ И КЛАССИФИКАЦИЯ МИКОБАКТЕРИЙ Перельман
Все микобактерии разделяют на патогенные для человека и условно-патогенные.
В клинической микробиологии используют несколько подходов для классификации микобактерий:
• по скорости и оптимальной температуре роста, способности к образованию пигмента;
• по клинически значимым комплексам.
Вызывающие туберкулёз виды микобактерий объединены в комплекс М. tuberculosis, включающий М. tuberculosis, М. bovis. М. bovis BCG, М. africanum, М. microti, М. canettii. В последнее время к нему отнесены М. pinnipedii, М. саргае, филогенетически имеющие отношение к М. microti и М. bovis.
Остальные микобактерии, вызывающие различные микобактериозы, отнесены к группе нетуберкулёзных микобактерий. Из этой группы выделяют следующие комплексы:
М. avium, состоящий из М. avium, М. intracellulare, М. scrofulaceum;
M.fortuitum включающий подвиды M.fortuitum и М. chelonae, и
М. terrae, включающий М. terrae, М. triviale и М. nonchromogenicum.
Важнейшие группы составляют:
возбудители проказы М. leprae, а также
возбудители язвенных поражений Buruli М. ulcerans.
РОСТ И РАЗМНОЖЕНИЕ МИКОБАКТЕРИЙ
Микобактерии туберкулёза размножаются крайне медленно: период удвоения 18-24 (14-18)ч (обычные бактерии делятся каждые 15 мин). Поэтому для получения видимого роста типичных колоний требуется не менее 4-6 нед. Одной из причин медленного размножения микобактерий считают их выраженную гидрофобность которая затрудняет диффузию питательных веществ. Более вероятно, что это гене- тически детерминировано и связано с более сложным устройством микобактерий. Известно, например, что большинство бактерий имеет множество копий оперона рибосомалыюй рибонуклеиновой кислоты (рРНК). Медленно растущие микобак- терпи (М. tuberculosis, М. leprae) имеют по одной копии оперона, а быстрорастущие (М. smegmatis) — лишь две копии.
ГЕНЕТИКА МИКОБАКТЕРИЙ
Род микобактерий с генетической точки зрения очень разнообразен. В отличие от многих сапрофитных и нетуберкулёзных микобактерий микобактерии туберкулёза не содержат экстрахромосомных включений (например, плазмид). Всё разнообразие свойств микобактерий туберкулёза определяется её хромосомой.
Геном М. tuberculosis complex чрезвычайно консервативен. Его представители обладают гомологией ДНК на уровне 85-100%. в то время как ДНК других видов микобактерий гомологичны М. tuberculosis лишь на 4-26%.
Представители рода микобактерий имеют по сравнению с другими прокариотами большие геномы — 3,1-4,5x109 Да. однако геномы патогенных видов меньше, чем у других микобактерий (у М. tuberculosis - 2,5x109 Да). У классического возбудителя туберкулёза человека, М. tuberculosis, больше генов, чем у М. africanum и М. bovis, которые утратили часть генетического материала в ходе эволюции.
Более 20% генома занимают гены метаболизма жирных кислот клеточной стенки, в том числе миколовых кислот, богатых глицином кислых полипептидов (семейства РЕ и РРЕ), кодируемых полиморфными участками генома PGRS (Polymorphic GC-rich repetitive sequence) и MPTR (Major polymorphic tandem repeat), соответственно (пятое и четвёртое кольца геномной хромосомной карты). Вариабельность этих участков генома обеспечивает различия антигенов и способность ингибировать иммунный ответ. В геноме микобактерии туберкулёза широко представлены гены, контролирующие факторы вирулентности.
Микобактерии туберкулёза синтезируют все необходимые для обмена компоненты: незаменимые аминокислоты, витамины, ферменты и кофакторы. По сравнению с другими видами бактерий у М. tuberculosis повышена активность ферментов липогенеза. Два гена кодируют гемоглобинподобные белки, играющие роль антиокислительных протекторов или ловушек избытка клеточного кислорода. Эти особенности способствуют быстрой адаптации микобактерий туберкулёза к резким изменениям условий окружающей среды.
Особенность генома М.tuberculosis complex - большое число повторяющихся последовательностей ДНК. Так. в хромосоме М. tuberculosis H37Rv насчитывают до 56 копий IS-элементов (insertion sequences — встраивающихся последовательностей), которые обеспечивают ДНК-полиморфизм микобактерий туберкулёза. Большинство из них. за исключением элемента IS6110. неизменны. В составе хромосомы различных штаммов микобактерий туберкулёза, как правило, присутствует от 5 до 20 копий IS6110, однако встречаются штаммы, не имеющие данного элемента. Наряду с IS-элементами геном содержит несколько типов коротких повторов нуклеотидов (PGRS и MPTR), а также прямые повторы DR (Direct Repeat), находящиеся в DR-области и разделённые вариабельными последовательностями — спейсерами (шестое кольцо на карте хромосомы). Различия в количестве копий и локализации на хромосоме этих генетических элементов используют для дифференциации штаммов микобактерий туберкулёза в молекулярной эпидемиологии. Наиболее совершенные схемы генотипирования микобактерий основаны на выявлении геномного полиморфизма, обусловленного элементом IS6110, а также DR и их спейсерами. Характерно, что дивергенция вида М. tuberculosis происходит, как правило, за счёт рекомбинаций между копиями элемента IS6110. которые фланкируют различные гены.
В геноме H37Rv найдены два профага - phiRv1 и phiRv2. Как и полиморфный сайт Dral они. вероятно, ассоциированы с факторами патогенности, поскольку именно эти участки генома отличаются от аналогичных участков авирулентных штаммов М. tuberculosis H37Ra и М. bom BCG, Определены участки генома (mutT, ogt-genes), отвечающие за увеличение частоты мутаций и адаптацию микобактерий туберкулёза в прессовых условиях. Обнаружение триггерных генов дормантности микобактерий туберкулёза изменило представление о латентной туберкулёзной инфекции.
Особое место занимает семейство Beijing, впервые выявленного в гистологических препаратах лёгочной ткани 1956-1990 гг. от больных предместья Пекина. На сегодняшний лень штаммы этого семейства обнаружены в государствах Азии. Южной Африки, странах Карибского бассейна, США. Недавно получены данные о распространении штаммов генотипа SI/Beijing на северо-западе европейской части России (Санкт-Петербург) и в регионах Сибири.
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ
С клинической точки зрения лекарственная чувствительность микроорганизма определяет возможность применения стандартной химиотерапии показанным препаратом для лечения заболевания, вызванного выделенным штаммом.
В микробиологии в основе определения лекарственной чувствительности или лекарственной устойчивости лежит популяционный подход, подразумевающий разную степень устойчивости пула (разнородной совокупности) микробных клеток.
Лекарственную устойчивость оценивают в количественных характеристиках, таких, как «минимальная ингибирующая концентрация» (МИК). Например, при МИК-90 гибнет 90% микроорганизмов (бактериостатическая концентрация).
Таким образом, под резистентностью следует понимать её степень у части микробной популяции, которая предопределяет неудачу лечения в большинстве случаев. Общепринято, что 10% устойчивых штаммов среди всей микробной популяции больного способно оказать патогенное действие.
Во фтизиобактериологии для противотуберкулёзных препаратов первого ряда она составляет 1%, или 20 колониеобразующих единиц — КОЕ). Такая часть микробной популяции через месяц способна вытеснить исходную и сформировать очаг поражения. Для противотуберкулёзных препаратов второго ряда критерием устойчивости служит 10% рост микробной популяции.
Развитие лекарственной устойчивости микроорганизмов связано с селекцией (отбором) в присутствии антибиотика и с преимущественным выживанием части микробной популяции, имеющей механизмы защиты против антибактериального агента. В каждой популяции находится незначительное количество мутантных клеток (как правило, 106-109), резистентных к тому или иному препарату (табл. 5-2). При проведении химиотерапии погибают чувствительные микробные клетки, а резистентные размножаются. В результате происходит замещение чувствительных клеток устойчивыми (рис. 5-5.)
Микобактерии исходно обладают высокой природной устойчивостью ко многим антибактериальным препаратам широкого спектра действия, однако у разных видов — различные спектр и степень этой чувствительности.
Под истинной природной устойчивостью понимают постоянный видовой признак микроорганизмов, связанный с отсутствием мишени действия антибиотика или недоступностью мишени вследствие первично низкой проницаемости клеточной стенки, ферментативной инактивации вещества или других механизмов.
Приобретённая устойчивость — свойство отдельных штаммов сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют рост основной части микробной популяции. Приобретение резистентности во всех случаях обусловлено генетически: появлением новой генетической информации или изменением уровня экспрессии собственных генов.
В настоящее время обнаружены различные молекулярные механизмы устойчивости микобактерий туберкулёза:
• инактивация антибиотика (ферментная инактивация), например, β-лактамазами;
• модификация мишени действия (изменение пространственной конфигурации белка вследствие мутации соответствующего участка генома):
• гиперпродукция мишени, приводящая к изменению соотношения агент-мишень и высвобождению части белков жизнеобеспечения бактерии;
• активное выведение препарата из микробной клетки (эффлюкс) вследствие включения стрессорных механизмов защиты:
• изменение параметров проницаемости внешних структур микробной клетки, блокирующих способность антибиотика проникать внутрь клетки;
• включение «метаболического шунта» (обходного пути обмена).
Помимо прямого воздействия на метаболизм микробных клеток, многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты. L-формы). а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика.
Все механизмы формируют разную степень устойчивости, обеспечивая резистентность к разным концентрациям химиопрепаратов, поэтому появление у бактерий устойчивости не всегда сопровождается снижением клинической эффективности антибиотика
ВИДЫ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ
Различают первичную и приобретённую лекарственную устойчивость. К микроорганизмам с первичной устойчивостью относят штаммы, выделенные от пациентов, не получавших специфическую терапию или получавших препараты в течение месяца или менее. При невозможности уточнения факта применения противотуберкулёзных препаратов используют термин «начальная устойчивость».
Первичная лекарственная устойчивость имеет большое клиническое и эпидемиологическое значение, поэтому для правильной её оценки необходимо не проводить впервые выявленному больному туберкулёзом химиотерапию до микробиологического исследования диагностического материала. Частоту первичной лекарственной устойчивости рассчитывают как отношение количества впервые выявленных больных туберкулёзом с первичной резистентностью к числу всех впервые выявленных больных, которым проводили исследование на лекарственную чувствительность в течение года.
Если устойчивый штамм выделен у пациента на фоне противотуберкулёзной терапии, проводимой в течение месяца и более, устойчивость расценивают как приобретённую. Частота первичной лекарственной устойчивости характеризует эпидемиологическое состояние популяции возбудителя туберкулёза.
Приобретённая лекарственная устойчивость среди впервые выявленных больных - результат неудачного лечения:
- неверный подбор препаратов,
-несоблюдение режима приёма,
- снижение дозировок препаратов,
- непостоянное снабжение и плохое качество препаратов.
Эти факторы приводят к снижению системной концентрации препаратов в крови и их эффективности, одновременно «запуская» в клетках микобактерий защитные механизмы.
В структуре лекарственной устойчивости микобактерий туберкулёза различают:
Монорезистентность - устойчивость к одному из противотуберкулёзных препаратов, чувствительность к другим препаратам сохранена. При применении комплексной терапии монорезистентность выявляют довольно редко и. как правило, к стрептомицину (в 10-15% случаев среди впервые выявленных больных).
Полирезистентность - устойчивость к двум и более препаратам.
Множественная лекарственная устойчивость - устойчивость к изониазиду и рифампицину одновременно (независимо от наличия устойчивости к другим препаратам). Она сопровождается, как правило, устойчивостью к стрептомицину и др. В настоящее время МЛУ возбудителей туберкулёза стала эпидемиологически опасным явлением. Расчёты показывают, что выявление возбудителей с МЛУ более чем в 6,6% случаев (среди впервые выявленных больных) требует изменения стратегии Национальной противотуберкулёзной программы. В России, по данным мониторинга лекарственной устойчивости, частота МЛУ среди впервые выявленных больных составляет от 4 до 15%, среди рецидивов — 45-55%, а среди случаев неудачного лечения - до 80%.
Суперустойчивость - множественная лекарственная устойчивость в сочетании с устойчивостью к фторхинолонам и одному из инъекционных препаратов (канамицин, амикацин, капреомицин). Туберкулёз, вызванный штаммами с суперустойчивостью, представляет прямую угрозу для жизни пациентов, так как остальные противотуберкулёзные препараты второго ряда не имеют выраженного антибактериального дейс- твия. С 2006 г. в некоторых странах организовано наблюдение за распространением штаммов микобактерий с суперустойчивостью. За рубежом принято обозначать этот вариант МЛУ как XDR.
Перекрёстная устойчивость - когда возникновение устойчивости к одному препарату влечет за собой устойчивость к другим препаратам. У М. tuberculosis, как правило, ассоциированные с устойчивостью мутации не взаимосвязаны. Развитие перекрёстной устойчивости обусловлено сходством химической структуры некоторых противотуберкулёзных препаратов. Особенно часто перекрёстную устойчивость выявляют внутри одной группы препаратов, например аминогликозидов (табл. 5-3). Для прогнозирования перекрёстной резистентности необходимы исследования культуры микобактерий на генетическом уровне в сочетании с микробиологическим изучением устойчивости.
ПАТОГЕНЕЗ И ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ ТУБЕРКУЛЕЗА
В развитии туберкулеза выделяют два периода — первичный и вторичный. Необходимость такого деления обусловлена существенными различиями в реакции организма человека на первый и повторный контакты с МБТ.
Первичный период туберкулезной инфекции начинается с момента первого внедрения в организм вирулентных МБТ. В большинстве случаев первичное инфицирование не приводит к заболеванию благодаря адекватной реакции защитных систем организма. При несостоятельности иммунной защиты, массивности и высокой вирулентности инфекции первичное экзогенное инфицирование вызывает развитие первичного туберкулеза.
Завершение первичного периода туберкулезной инфекции связано с разрушением большей части МБТ и элиминацией из организма остатков микробных тел. Небольшая часть микобактериальной популяции инкапсулируется в остаточных изменениях.
При благоприятном исходе первичного инфицирования, когда организму человека удается преодолеть бактериальную агрессию и заболевание не возникает, эти остаточные морфологические изменения определяются лишь при микроскопическом исследовании. При клиническом исследовании они недоступны для визуализации.
В отличие от них остаточные посттуберкулезные изменения, образовавшиеся в процессе обратного развития первичного туберкулеза, более значительны. Их можно выявить посредством рентгенологического исследования.
В течение первичного периода туберкулезной инфекции формируется противотуберкулезный иммунитет, обеспечивающий повышение устойчивости организма к МБТ.
Клиническими формами первичного туберкулеза являются: туберкулезная интоксикация, туберкулез внутригрудных лимфатических узлов и первичный туберкулезный комплекс.
Вторичный период туберкулезной инфекции (вторичный туберкулез) развивается двумя путями.
- Один из них — повторное заражение МБТ человека, перенесшего первичный период туберкулезной инфекции (экзогенная суперинфекция);
- другой — реактивация остаточных посттуберкулезных изменений, сформировавшихся в исходе первичного периода (эндогенная реактивация).
Обязательным условием развития вторичного туберкулеза является снижение напряженности клеточного иммунитета, которое наступает под воздействием разных неблагоприятных факторов внешней и внутренней среды.
При благоприятном течении вторичный период заканчивается формированием остаточных посттуберкулезных изменений, которые по своей морфологической структуре отличаются от остаточных изменений первичного генеза.
Клиническими формами вторичного туберкулеза, согласно принятой в России классификации, являются очаговый туберкулез, инфильтративный, казеозная пневмония, туберкулема, кавернозный, фиброзно-кавернозный и цирротический туберкулез.
Некоторые формы туберкулеза имеют своеобразное течение, которое нельзя в полной мере отнести к первичному или вторичному периоду туберкулезной инфекции. Туберкулез, имеющий такое течение, принято называть послепервичным.
Он может развиваться при прогрессировании первичного туберкулеза или в результате реактивации остаточных посттуберкулезных изменений первичного генеза. К послепервичным относят диссеминированные формы туберкулеза.
ФАКТОРЫ РИСКА РАЗВИТИЯ ТУБЕРКУЛЕЗА ПОСЛЕ ИНФИЦИРОВАНИЯ МБТ
После того как МБТ попадают в организм, наступает инфицирование, которое в одних случаях длится неопределенно долго (всю жизнь), в других — переходит в болезнь.
Латентной туберкулезной инфекцией считают такой инфекционный процесс, при котором отсутствуют клинические проявления туберкулеза при наличии жизнеспособных МБТ в организме. Латентная туберкулезная инфекция принадлежит к группе бессимптомных инфекций, при которых МБТ существуют в очаге инфекции, но не вызывают клинических проявлений заболевания даже в течение многих лет. МБТ, находящиеся в дремлющем или неактивном состоянии, при ослаблении иммунобиологической резистентности организма под влиянием различных неблагоприятных факторов вновь становятся активными, и тогда развивается клинически обусловленное заболевание — туберкулез.
Наиболее важное эпидемиологическое значение имеют активные и заразные формы туберкулеза.
Активные формы туберкулеза — заболевания туберкулезом с клиническими, лабораторными и рентгенологическими признаками активности процесса.
Заразные формы туберкулеза — активные формы туберкулеза с выделением МБТ.
В большинстве случаев невозможно выяснить причины развития или не развития туберкулеза у конкретного человека, но можно говорить о наличии
трёх основных групп факторов, определяющих повышенный риск заболевания туберкулёзом:
• тесного контакта с больными туберкулёзом (бытового и производственного);
• различных заболеваний и состояний, снижающих резистентность организма и создающих условия для развития туберкулёза;
• социально-экономических, бытовых, экологических, производственных и прочих факторов.
Факторы, которые увеличивают риск прогрессирования субклинической инфекции МВТ в заболевание:
Генетические факторы:
• достоверность риска развития туберкулеза значительно выше среди монозиготных, чем среди дизиготных близнецов;
• конституция человека — заболеваемость туберкулезом среди лиц с пониженной массой тела в 2—4 раза выше, чем среди лиц с нормальной массой. При увеличении индекса массы тела заболеваемость легочным (но не внелегочным) туберкулезом уменьшается;
• пол (чаще болеют мужчины, хотя в некоторых местностях, например Пуэрто-Рико, заболеваемость у женщин на 18 % больше, чем у мужчин. Некоторые клинические формы туберкулеза, например туберкулез лимфатической системы, может встречаться одинаково часто среди детей обоих полов);
• группа крови — риск заболеть туберкулезом значительно выше у лиц с группой крови АВ (IV) и В (III);
• наследственные заболевания (дети, страдающие гемофилией, имеют высокий риск развития туберкулеза);
• тип HLA-гистосовместимости (риск развития туберкулеза увеличен в 1,5—3,5 раза у людей с HLA-типом гистосовместимости All—В15 и DR2);
• риск развития туберкулеза значительно выше в популяциях, которые ранее не контактировали с возбудителем туберкулеза;
• возраст — фактор, имеющий генетическую детерминанту (подростки и молодые люди наиболее склонны к прогрессированию из стадии латентной туберкулезной инфекции в стадию заболевания; дети в возрасте около 10 лет наименее склонны. Растет уровень заболевания среди взрослых в возрасте до 60 лет; риск развития туберкулеза после инфицирования увеличивается и после 60 лет. В развивающихся странах высок риск развития туберкулеза в трудоспособном возрасте).
Факторы внешней среды:
• недостаточное и несбалансированное питание (вегетарианская диета — фактор риска развития туберкулеза. Чем меньше человек употребляет мяса или рыбы, тем больше риск заболевания туберкулезом. Самый высокий риск у вегетарианцев, соблюдающих молочную диету);
• курение (заболеваемость туберкулезом выше среди курящих, чем среди некурящих, при этом имеет значение количество и качество выкуриваемых сигарет в день);
• наркомания или злоупотребление психоактивными веществами (после инфицирования риск развития туберкулеза выше среди лиц, употребляющих внутривенные наркотики, чем среди тех, кто не употребляет наркотики; это доказано еще до открытия ВИЧ);
• злоупотребление алкоголем — точных эпидемиологических данных о причинной взаимосвязи не существует, но поскольку иммунные механизмы под влиянием алкоголя ослабевают, то злоупотребление алкоголем может увеличивать риск развития туберкулеза (Г.Л. Ридер, 2000).
Факторы сопутствующих заболеваний и состояний:
• сахарный диабет — частота туберкулеза среди больных с сахарным диабетом составляет 8,4 % , среди рабочих и служащих, не болеющих сахарным диабетом, — 4,3 % (Г.Л. Ридер, 2001);
• злокачественные новообразования (зарегистрированы частые случаи туберкулеза среди пациентов, страдающих злокачественными лимфомами, раком легких, головы и шеи);
• силикоз (заболеваемость туберкулезом среди шахтеров, больных силикозом и пневмокониозом, в 23—30 раз больше, чем среди шахтеров, не страдающих профессиональными заболеваниями);
• продолжительная терапия кортикостероидами (глюкокортикоиды в высоких дозах снижают сопротивляемость организма к действию МБТ). Это показание для проведения профилактических мероприятий;
• почечная недостаточность (у пациентов с терминальной почечной недостаточностью, находящихся на гемодиализе, в 10—15 раз больше риск развития туберкулеза, чем в общей популяции);
• корь (уменьшает интенсивность соответствующей реакции при постановке туберкулиновой пробы Манту и может увеличивать риск туберкулеза);
• гастрэктомия (после гастрэктомии риск развития туберкулеза в 5 раз больше, чем в общей популяции. Вероятно, эта связь вторична и обусловлена снижением массы тела после операции и несбалансированным питанием);
• беременность и роды (в послеродовой период риск прогрессирования бессимптомной туберкулезной инфекции в стадию заболевания в 2 раза выше, чем во время беременности);
• ВИЧ-инфекция (риск развития туберкулеза у ВИЧ-инфицированных лиц зависит от наличия туберкулезной инфекции и уровня иммунодепрессии. Риск значительно выше, если туберкулезная инфекция присоединяется после инфицирования ВИЧ);
• остаточные фиброзные изменения после спонтанно излеченного туберкулеза (у лиц, которые перенесли туберкулез со спонтанным выздоровлением и формированием фиброза, существует высокий риск повторного развития заболевания. Рентгенологические остаточные изменения после перенесенного туберкулеза являются важным фактором риска реактивации патологического процесса: чем больше размеры фиброзных изменений, тем выше риск повторного развития туберкулеза).
Факторы особенностей МБТ:
• инфицирующая доза МБТ (риск развития туберкулеза выше, если инфицирование произошло от пациента, в мазках мокроты которого были обнаружены МБТ, чем в случаях, когда источником инфицирования является пациент, в мокроте которого МБТ не определялись);
• вирулентность штамма МБТ (риск заболевания туберкулезом у пациентов, инфицированных высоковирулентными штаммами выше, чем при инфицировании мало- и авирулентными штаммами. Лица, инфицированные резистентными штаммами МБТ, контагиозны более продолжительное время, чем лица, инфицированные МБТ, чувствительными ко всем противотуберкулезным препаратам);
• инфицирование М. bovis. Риск заболевания после инфицирования М. bovis значительно ниже, чем в случае инфицирования М. tuberculosis. Риск развития туберкулеза после инфицирования М. tuberculosis в 7—12 раз выше, чем после инфицирования М. bovis).
Фактор реинфекции:
Лица с положительными кожными туберкулиновыми пробами имеют значительно меньший риск развития туберкулеза, чем те, у кого результаты пробы отрицательные. Инфицирование, произошедшее ранее, обеспечивает определенную защиту против реинфекции по сравнению с инфицированием, состоявшимся недавно. Поэтому неинфицированных необходимо вакцинировать, поскольку у ранее инфицированных лиц клеточная иммунная система готова быстрее ответить на размножение МБТ и их диссеминацию, чем иммунологически неподготовленная система. Однако абсолютной защиты от реинфекции не существует. У некоторых вылеченных пациентов заболевание развивается вновь, но, как правило, оно обусловливается резистентным штаммом МБТ, или штаммом с иным фаготипом, или штаммом с иным полиморфизмом длины рестрикционного фрагмента (RFLP) по сравнению с предыдущим эпизодом туберкулеза. У ранее инфицированных взрослых защита от реинфекции приблизительно обеспечена на 40 %.
Риск развития туберкулеза после инфицирования МБТ изучали при определении эффективности химиопрофилактики у лиц, имевших контакты с больными туберкулезом в домашних условиях. Установлено, что риск развития туберкулеза повышен в течение первого года после инфицирования, затем резко снижается и остается низким длительное время. Эмпирически установлено, что риск развития нового случая заболевания туберкулезом после инфицирования ребенка младшего возраста (1—3 года) в течение жизни составляет 10 %, при этом половина этого риска приходится на первые 5 лет после инфицирования.
ПАТОМОРФОЛОГИЯ ТУБЕРКУЛЕЗА
ВЗАИМОДЕЙСТВИЕ МАКРОФАГ-МИКОБАКТЕРИЯ Перельман
Макрофаги играют чрезвычайно важную роль в защите от туберкулёзной инфекции как на фазе распознавания антигена, так и элиминации микобактерии.
После проникновения микобактерий в лёгкие ситуация может развиваться в соответствии с четырьмя основными схемами:
• первичная реакция хозяина может оказаться достаточной для полной элиминации всех микобактерий, исключая тем самым возможность заболевания туберкулёзом;
• в случае быстрого роста и размножения микроорганизмов развивается заболевание, известное как первичный туберкулёз;
• при латентной инфекции заболевание не развивается, но микобактерии персистируют в организме в так называемом покоящемся состоянии, и их присутствие проявляется лишь в виде положительной кожной реакции на туберкулин;
• в некоторых случаях микобактерии способны переходить из состояния покоя в фазу роста, и латентная инфекция сменяется реактивацией туберкулёза.
Первой линией защиты против инфекции, после того как микобактерии достигли нижнего отдела респираторного пути, служат альвеолярные макрофаги. Эти клетки способны непосредственно подавлять рост бактерий, фагоцитируя их, а также участвовать в широком спектре реакций клеточного противотуберкулёзного иммунитета - через презентацию антигена, стимуляцию накопления Т-лимфоцитов в очаге воспаления и др. Важно отметить, что специфические механизмы связывания вирулентных и относительно авирулентных штаммов микобактерий с фагоцитами могут различаться.
Процесс формирования вакуоли или фагосомы при взаимодействии М. tuberculosis с мононуклеарным фагоцитом опосредован прикреплением микроорганизма к рецепторам комплемента (CR1, CR3, CR4), маннозным рецепторам или другим рецепторам клеточной поверхности. Взаимодействие между маннозными рецепторами фагоцитирующих клеток и микобактериями опосредовано, по-видимому, гликопротеином клеточной стенки микобактерий — липоарабиноманнаном.
РОЛЬ Т-ЛИМФОЦИТОВ В ПРОТИВОТУБЕРКУЛЁЗНОМ ИММУНИТЕТЕ
Т-лимфоциты, как известно, являются основным компонентом приобретённого иммунитета при туберкулёзной инфекции. Иммунизация экспериментальных животных микобактериальными антигенами, а также течение туберкулёзной инфекции сопровождаются генерацией антигенспецифических лимфоцитов CD4+ и CD8+. Известно, что у больных СПИДом, для которых характерен дефицит лимфоцитов CD4+, отмечают крайне высокую чувствительность к туберкулёзу.
Механизмы эффекторного действия Т-лимфоцитов сводятся в основном либо к продукции растворимых факторов (цитокинов, хемокинов), либо к цитотоксичности. При микобактериальных инфекциях происходит преимущественное образование Т1, характерными чертами которых является продукция цитокинов ИФН-γ и ФНО-α. Оба цитокина способны стимулировать антимикобактериальную активность макрофагов, чем. в первую очередь, и обусловлен протективный эффект лимфоцитов CD4. Помимо этого, ИФН-γ способен подавлять степень выраженности воспалительных реакций в лёгких и тем самым уменьшать тяжесть течения туберкулёзной инфекции. ФНО-α необходим для гранулёмообразования, полноценной кооперации макрофагов и лимфоцитов и протекции тканей от некротических изменений. Наряду с протективным действием, ФНО-α обладает и «патологическим» эффектом. Его продукция может приводить к лихорадке, потере массы тела и повреждению тканей - симптомам, характерным для туберкулёзной инфекции. Т-лимфоциты являются не единственным источником ФНО-α. Его основные продуценты — макрофаги.
3.1. Первичное инфицирование микобактериями туберкулеза и скрытое течение туберкулезной инфекции (Перельман)
Первичное заражение человека МБТ обычно происходит аэрогенным путем. Другие пути проникновения микобактерий — алиментарный, контактный и трансплацентарный — наблюдаются значительно реже.
При аэрогенном заражении МБТ защитную роль играет система мукоцилиарного клиренса, обеспечивающая склеивание и элиминацию поступивших в дыхательные пути микобактерий. Этот универсальный механизм защиты при эпизодическом, кратковременном контакте с бактериовыделителем он позволяет избежать инфицирования МБТ. Нарушения мукоцилиарного клиренса, возникающие при остром или хроническом воспалении дыхательных путей, а также при воздействии токсичных веществ, создают предпосылки для поступления МБТ в бронхиолы и альвеолы, вероятность аэрогенного инфицирования МБТ значительно увеличивается.
При алиментарном пути заражения МБТ возможность и исход первичного инфицирования в значительной степени зависят от состояния кишечной стенки и всасывающей функции кишечника.
Контактный путь— попадание МБТ непосредственно через поврежденную кожу или конъюнктиву. Может наблюдаться у хирургов, патологоанатомов, лаборантов, мясников, доярок;
Внутриутробный (трансплацентарный) путь — неповрежденная плацента является барьером на пути МБТ от матери к плоду, поэтому внутриутробная инфекция может развиться при генерализованных формах процесса, когда туберкулезом поражается плацента, а также в случаях родовой травмы, когда происходит смешивание крови плода и матери.
В зависимости от места внедрения МБТ первоначально могут проникать в легкое, миндалины, кишечник и другие органы и ткани. Поскольку возбудители туберкулеза не выделяют экзотоксин, а возможности для их фагоцитоза на этом этапе весьма ограничены, присутствие в тканях небольшого числа микобактерий обычно проявляется не сразу.
Микобактерии находятся внеклеточно, медленно размножаются, а окружающая их ткань сохраняет нормальную структуру. Такое состояние определяется как латентный микробизм, при котором макроорганизм проявляет толерантность к МБТ.
Независимо от начальной локализации микобактерии с током лимфы довольно быстро попадают в регионарные лимфатические узлы, а затем лимфогематогенным путем распространяются по организму. Возникает первичная облигатная (обязательная) микобактериемия.
Микобактерии оседают в органах с наиболее развитым микроциркуляторным руслом — в легких, лимфати ческих узлах, корковом слое почек, эпифизах и метафизах трубчатых костей, ампуллярно-фимбриональных отделах маточных труб, увеальном тракте глаза.
МБТ, оседая в различных тканях, продолжают размножаться. Популяция возбудителей туберкулеза может значительно увеличиться, прежде чем сформируется иммунитет и появится реальная возможность для их разрушения и элиминации.
В месте расположения микобактериальной популяции возникает неспецифическая защитная реакция — фагоцитоз.
Первыми фагоцитирующими клетками, которые пытаются поглотить и разрушить МБТ, являются полинуклеарные лейкоциты. Однако их бактерицидный потенциал оказывается не достаточным для защитной функции. Полинуклеарные лейко циты, вступившие в контакт с МБТ, погибают.
Вслед за полинуклеарами с МБТ взаимодействуют макрофаги. В большинстве случаев первичный контакт МБТ и макрофага происходит на фоне дисфункции лизосом фагоцитирующей клетки. Появление этой дисфункции связано с повреждающим воздействием на лизосомальные мембраны сульфатидов и кордфактора МБТ. Дисфункция лизосом препятствует обра зованию фаголизосомы, и лизосомальные ферменты не могут воздействовать на поглощенные микобактерии, и макрофаг становится своеобразным контейнером для возбудителя туберкулеза (незавершенный фагоцитоз).
Внутриклеточно расположенные МБТ продолжают расти, размножаться и инициировать образование веществ, которые оказывают повреждающее действие на клетку хозяина. Макрофаг погибает, и микобактерии вновь попадают в межклеточное пространство.
Дальнейшая судьба микобактерий и исход первичного инфицирования зависят от способности организма активировать макрофаги и создавать условия для завершенного фагоцитоза.
В месте локализации МБТ развивается специфическая клеточная реакция, способная ограничить их распространение. Макрофаги трансформируются в эпителиоидные клетки и гигантские многоядерные клетки Пирогова—Лангханса, которые принимают участие в ограничении зоны воспаления.
Образуется туберкулезная гранулема, которая является морфологическим проявлением иммунной реакции организма на МБТ-агрессию. Формирование гранулемы свидетельствует о высокой иммунологической активности и способности организма локализовать туберкулезную инфекцию. Компактное расположение клеток гранулемы обеспечивает лучшие условия для взаимодействия фагоцитирующих и иммунокомпетентных клеток.
В центре гранулемы может появиться небольшой участок казеозного некроза, формирующийся из тел макрофагов, которые погибли при контакте с МБТ. В гранулеме находится множество макрофагов, которые продолжают выполнять фагоцитарную, аффекторную и эффекторную функции в иммунном ответе. Эпителиоидные клетки менее способны к фагоцитозу, они активно осуществляют пиноцитоз и синтез гидролитических ферментов.
Отдельные гранулемы сливаются, объем туберкулезного поражения увеличивается. Изменяется биологическая сущность процесса: первичное инфицирование трансформируется в клинически выраженный туберкулез.
В активации макрофагов и повышении устойчивости организма к действию МБТ ведущая роль принадлежит приобретенному клеточному иммунитету, в основе которого лежит эффективное взаимодействие макрофагов и лимфоцитов.
При адекватном развитии иммунного ответа каждое последующее поколение макрофагов, вступающее во взаимодействие с туберкулезным возбудителем, становится все более иммунокомпетентным. Высокий бактерицидный потенциал активированных макрофагов обеспечивает возможность разрушения поглощенных МБТ и защиту человека от возбудителя туберкулеза.
Выделяемые макрофагами медиаторы активируют и В-лимфоциты, ответственные за синтез иммуноглобулинов. Однако накопление в крови имуноглобулинов практически не повышает устойчивость организма к МБТ. Полезным можно считать лишь образование опсонизирующих антител, которые формируются к полисахаридным компонентам МБТ. Они обволакивают микобактерии и способствуют их склеиванию, облегчая последующий фагоцитоз.
При первичном инфицировании МБТ становление иммунитета происходит одновременно с медленным размножением микобактерий и развитием локальных воспалительных изменений.
Повышение ферментативной активности макрофагов и лимфоцитов приводит к дополнительному синтезу веществ, инициирующих повышение сосудистой проницаемости и развитие воспалительной реакции. Такими веществами являются фактор роста, фактор переноса, кожно-реактивный фактор, ФНО-α, оксид азота. С их действием связывают появление у клеток повышенной чувствительности замедленного типа (ПЧЗТ) к антигенам МБТ. На высоте гранулематозной реакции в гранулемах преобладают Т-лимфоциты, присутствуют и В-лимфоциты.
Реакция ГЧЗТ появляется через 2—3 нед после инфицирования, а достаточно выраженный клеточный иммунитет формируется через 8 нед.
По мере развития иммунного ответа размножение микобактерий замедляется, их общее число уменьшается, специфическая воспалительная реакция затихает.
Однако окончательной ликвидации возбудителя туберкулеза не происходит даже при полноценном взаимодействии макрофагов и Т-лимфоцитов. Определенная популяция МБТ сохраняется в организме хозяина в виде живых, нередко биологически измененных особей (в частности, L-форм). Они локализуются в единичных туберкулезных гранулемах, окруженных плотной фиброзной капсулой.
Сохранившиеся МБТ локализуются внутриклеточно и предотвращают формирование фаголизосомы, по этому для лизосомальных ферментов они недоступны.
В связи с сохранением микобактерий противотуберкулезный иммунитет называют нестерильным. Оставшиеся в организме МБТ поддерживают популяцию сенсибилизированных Т-лимфоцитов и обеспечивают достаточную эффективность защитных иммунологических реакций. Инфицированный микобактериями человек сохраняет их в своем организме весьма дли тельное время, иногда всю жизнь. При возникновении нарушений в иммунном балансе появляется реальная угроза активации сохранившейся микобактериальной популяции и заболевания туберкулезом.
Антимикобактериальная эффекторная функция макрофагов варьирует в зависимости от генетической структуры чело века, его возраста, пола, гормонального фона, наличия или отсутствия сопутствующих заболеваний. Она зависит также от вирулентности МБТ.
В целом риск развития туберкулеза у впервые инфицированного человека составляет около 8 % в первые 2 года после заражения, в последующие годы он постепенно снижается.
3.2. Клинически выраженный туберкулез
Недостаточная активация макрофагов и неэффективный фагоцитоз приводят к неконтролируемому размножению проникших в организм микобактерий и увеличению микобактериальной популяции в геометрической прогрессии. В течение 20 дней может появиться более 500 млн новых МБТ.
Их взаимодействие с полинуклеарными лейкоцитами и макрофагами приводит к массовой гибели фагоцитирующих клеток. При этом в межклеточное пространство поступает большое количество медиаторов и протеолитических ферментов, повреждающих прилежащие ткани.
Следствием является своеобразное «разжижение» тканей с формированием особой питатель ной среды, способствующей росту и размножению расположенных внеклеточно микобактерий.
Большая интенсивно размножающаяся популяция микобактерий индуцирует дисбаланс в иммунной защите: количество Т-супрессоров (CD8+) увеличивается, иммунологическая активность Т-хелперов (CD4+) уменьшается, наступает резкое усиление, а затем угнетение ПЧЗТ к антигенам МБТ. Воз- можности организма для локализации и отграничения возбудителя туберкулеза ухудшаются.
Воспалительная реакция приобретает распространенный характер. Возникают выраженные нарушения микроциркуляции с повышением проницаемости сосудистой стенки и поступлением в ткани белков плазмы, лейкоцитов и моноцитов.
В формирующихся туберкулезных гранулемах преобладает казеозный некроз, их клеточная со- ставляющая выражена слабо. Инфильтрация наружного слоя полинуклеарными лейкоцитами, макрофагами и лимфоидными клетками усиливается. Отдельные гранулемы сливаются, общий объем туберкулезного поражения увеличивается, первичное инфицирование трансформируется в клинически выраженный туберкулез.
3.3. Морфология локальных изменений
Тканевая реакция в месте локализации МБТ первоначально имеет неспецифический характер. Такая реакция наблюдается в тканях независимо от вида возбудителя. Происходят нарушения микроциркуляции, повышение проницаемости сосудистой стенки, локальный отек тканей, инфильтрация зоны поражения лейкоцитами, моноцитами и другими форменными элементами крови.
Первые специфические морфологические признаки туберкулезного воспаления появляются через 2—3 нед после инфицирования МБТ.
Специфическое воспаление. Развитие специфического для туберкулеза воспаления обусловлено иммунологическими сдвигами, которые возникают при взаимодействии макроорганизма с туберкулезным возбудителем. В связи с этим специфическую воспалительную реакцию при туберкулезе характеризуют как классический пример воспаления на иммунной основе. Основообразующим морфологическим элементом туберкулезного воспаления является бугорок, который чаще называют туберкулезной гранулемой.
Специфическое воспаление захватывает различные морфологические структуры пораженного органа — клетки паренхимы, лимфатические и кровеносные сосуды.
При туберкулезе легкого в специфическую воспалительную реакцию также вовлекаются бронхи.
Иммуноморфологические особенности специфического воспаления позволяют считать туберкулез гранулематозным заболеванием.
Функциональное состояние паренхиматозных клеток в зоне поражения существенно нарушается. В них отчетливо выявляются признаки дистрофии и деструкции.
Резко снижается резорбтивная функция лимфатических капилляров. Возникают повреждения эндотелия лимфатических капилляров с выходом лимфы в межклеточное пространство.
Наблюдаются грубые нарушения микроциркуляции с тромбозом мелких кровеносных сосудов. Повреждения кровеносных сосудов обусловлены фиксацией в их базальном слое циркулирующих иммунных комплексов (ЦИК), которые в виде очаговых отложений можно обнаружить при электронной микроскопии.
Кровеносные капилляры в туберкулезной гранулеме практически отсутствуют. Питание клеточных элементов осуществляется в основном путем омывания их тканевой жидкостью.
(1.5.ПАТОМОРФОЛОГИЯ ТУБЕРКУЛЕЗА Петренко)
Название «гранулема» происходит от латинского слова «зерно» — впервые оно было использовано Рудольфом Вирховом (1818) для описания опухолей, которые способны изъязвляться и давать рост грануляционной ткани.
Туберкулезная гранулема — не просто скопление клеток, характерных для воспаления, а участок активного действия многочисленных ферментов и цитокинов в очень сложном процессе удаления причинного фактора МБТ.
В формировании туберкулезной гранулемы принимают участие гематогенные (лимфоциты, моноциты, полиморфно-ядерные лейкоциты) и гистиогенные (гистиоциты, макрофаги, фибробласты, ретикулярные клетки, эндотелий кровеносных сосудов, плазматические и тучные клетки) лимфоциты.
Важнейшей отличительной особенностью туберкулезной гранулемы является наличие центрально расположенной зоны творожистого (казеозного) некроза — плотного аморфного клеточного детрита, который образовался вследствие повреждения и гибели фагоцитов.
Зона казеозного некроза окружена несколькими слоями эпителиоидных клеток, макрофагов, лимфоцитов и плазматических клеток. Среди эпителиоидных клеток обнаруживают большие многоядерные клетки Пирогова—Лангханса. В наружных отделах клеточного слоя — полинуклеарные лейкоциты и фибробласты.
Клеточные элементы, расположенные вокруг зоны казеозного некроза, образуют грануляционную ткань.
В клетках, расположенных ближе к казеозно-некротическим массам, развиваются признаки дистрофии и деструкции.
Иммуноморфологические особенности специфического воспаления позволяют считать туберкулез гранулематозным заболеванием. Клеточный состав гранулемы подвергается динамическим изменениям на разных стадиях ее развития.
Классификация туберкулезных гранулем (по преобладанию различных клеточных элементов):
• эпителиоидно-клеточные;
• лимфоидные;
• гигантоклеточные;
• некротические
.
Особенности клеточного состава гранулемы и выраженность некротических изменений зависят от
характера клеточной реакции в зоне поражения:
• при продуктивной клеточной реакции в гранулеме преобладают эпителиоидные, макрофагальные, многоядерные гигантские клетки. Наружная часть клеточного слоя содержит фибробласты, которые синтезируют коллаген. Некротические изменения в центре гранулемы выражены слабо, а иногда отсутствуют;
• при экссудативной клеточной реакции преобладают некротические изменения;
• при альтеративной клеточной реакции процесс характеризуется формированием некротических гранулем, в которых клеточный вал выражен крайне слабо, а иногда практически отсутствует.
Преобладание экссудативной тканевой реакции свидетельствует о прогрессировании туберкулезного воспаления. Постепенно происходит слияние гранулем.
В результате формируется туберкулезный очаг — патологическое образование диаметром до 1 см.
Прогрессирование очагов проявляется:
- расширением зоны перифокального воспаления и
- появлением новых туберкулезных гранулем с выраженной зоной некроза, окруженной слоем из немногочисленных эпителиоидных и единичных гигантских клеток.
Дальнейшее прогрессирование процесса приводит к слиянию очагов и формированию туберкулезных инфильтратов с участками казеозного некроза. В последующем наблюдается инфильтрация казеозных масс полинуклеарными лейкоцитами.
Протеолитические ферменты, выделяемые лейкоцитами, вызывают расплавление казеозных масс. При их отторжении формируются полости распада, которые затем могут трансформироваться в каверны.
Резкое угнетение клеточного иммунитета приводит к быстрому прогрессированию патологического процесса с возникновением некротических гранулем. Довольно быстро в пораженном органе формируются обширные зоны казеозного некроза.
Обратное развитие туберкулезного воспаления в большинстве случаев сопровождается:
постепенным рассасыванием экссудата,
уплотнением зоны казеозного некроза и
формированием вокруг туберкулезных гранулем и очагов соединительнотканной капсулы.
Рассасывание экссудата с трансформацией туберкулезных грануляций в соединительную ткань может привести к фиброзным (цирротическим) изменениям в пораженном органе.
В заживлении и последующем рубцевании гранулематозных очагов большое значение имеет инфильтрация их фибробластами, которые обеспечивают формирование коллагеновых волокон. Вследствие обратного развития патологического процесса они подвергаются гиалинозу. В капсуле, которая окружает туберкулезные гранулемы и очаги, иногда можно обнаружить скопления лимфоцитов. Их появление обычно обусловлено высокой эффективностью защитных иммунологических реакций.
Отсутствие в осумкованных очагах специфической грануляционной ткани указывает на благополучное завершение воспаления и подтверждает клиническое излечение туберкулеза с формированием
остаточных посттуберкулезных изменений. Эти изменения отличаются большим полиморфизмом. Они могут быть представлены:
рубцом,
инкапсулированным или кальцинированным фиброзным очагом,
участком очагового или диффузного пневмофиброза.
Иногда в конце туберкулезного воспаления формируются “санированные” полости распада.
Реже наблюдаются карнификация легкого и образование бронхоэктазов.
В остаточных посттуберкулезных изменениях среди фиброзных волокон находятся метаболически неактивные МБТ, поэтому они являются резервуаром эндогенной туберкулезной инфекции.
Такие изменения поддерживают противотуберкулезный иммунитет, а при неблагоприятных для макроорганизма условиях создают угрозу повторного заболевания туберкулезом.
Инволюция туберкулезного воспаления с полным рассасыванием патологических очагов, без каких-либо остаточных изменений и полной элиминацией МБТ из организма — большая редкость. Такой исход иногда возможен при неосложненных первичных формах туберкулеза.
ПАРАСПЕЦИФИЧЕСКИЕ ТКАНЕВЫЕ РЕАКЦИИ
Очень характерны для первичного туберкулеза.
Проникновение в организм МБТ нередко вызывает неспецифические изменения в тканях, которые:
- этиологически обусловлены наличием МБТ,
- но признаки специфического воспаления для них не характерны.
В связи с этим их принято называть параспецифическими.
Чаще всего они возникают при первичном или диссеминированном туберкулезе.
Морфологический субстрат параспецифических реакций представлен токсико-аллергическим тромбоваскулитом, а также периваскулярными узловатыми или диффузными инфильтратами, состоящими из мононуклеарных макрофагов, лимфоцитов и плазматических клеток. Такие изменения наиболее выражены в лимфатических узлах.
Они создают большое разнообразие клинических проявлений первичного туберкулеза, обусловливают его маски. Первичный туберкулез, особенно у взрослых, может протекать под маской:
бронхиальной астмы,
сердечно-сосудистых, эндокринных, желудочно-кишечных, нервно-дистрофических нарушений,
коллагеновых болезней, полисерозитов, полиартритов,
болезней крови, печени, почек.
Нередко в процесс вовлекаются бронхи с формированием лимфо-бронхолегочных поражений, которые иногда трактуются как хроническая пневмония.
Типичные клинические проявления параспецифических реакций:
• фликтена, • фликтенулезный конъюнктивит;
• узловатая эритема (подкожные гистиолимфоцитарные инфильтраты);
• ревматоидные гранулемы в легких, печени, почках;
• катар верхних дыхательных путей.
• аллергический плеврит.
При своевременной диагностике туберкулеза и адекватном лечении параспецифические изменения довольно быстро подвергаются обратному развитию без каких-либо остаточных изменений. При отсутствии лечения в зоне параспецифических реакций со временем могут возникнуть поражения специфического характера.
