
- •3) Температура, при которой наблюдается максимальная активность ферментов, называется оптимальной.
- •Напишите реакцию, которую катализирует лдг
- •Укажите субстрат, кофермент, витамин-предшественник, источник фермента
- •Объясните, по какому параметру можно оценить скорость ферментативной реакции
- •Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента.
- •Витамин к и система свертывания крови
- •ЦАмф--------амф
- •Напишите схему реакций переваривания лактозы в кишечнике, укажите фермент
- •Объясните, почему концентрация глюкозы в крови не увеличивалась
- •Укажите, будет ли наблюдаться у данного пациента непереносимость кисломолочных продуктов. Ответ обоснуйте
- •2)Дефицит лактазы - Лактазная недостаточность (гиполактазия)
- •2)Напишите схему процесса, обеспечивающего включение продукта этой реакции в дальнейший путь окисления до со2 и н2о в мышце сердца
- •Рассчитайте энергетический эффект указанного процесса
- •1) Лдг, и лдг2 (н-типы) - в аэробных, когда пируват быстро окисляется до со2 и н2о, а не восстанавливается до молочной кислоты.
- •Напишите реакцию гидролиза жира, полученного с пищей
- •Представьте схему ресинтеза таг в стенке кишечника
- •Напишите реакции, которые объясняли бы разницу в составе жиров пищи и жиров в составе хиломикронов
- •Ответ :
- •Ответ :
- •Ответ :
- •Ответ :
1+
При некоторых заболеваниях у больного повышается температура тела, что рассматривается как защитная реакция организма. Однако высокие температуры губительны для белков организма. Объясните, почему при температуре выше +40С нарушается функция белков и возникает угроза для жизни человека. Алгоритм решения:
Структура белков и связи, удерживающие их структуры в нативной конформации;
Как меняется структура и функции белков при повышении температуры?
Что такое оптимальная температура для фермента? Обратимая и необратимая инактивация
Структурная организация белков:
-первичная структура- то последовательно связанные аминокислоты: пептидная связь;
-вторичная структура – это способ светывания, скручивания полипептидной цепи в спиральную или иную конформацию: водородная связь;
-третичная структура – это общая форма или конформация полипептидной цепи: дисульфидная, ионная, гидрофобная связи;
-четвертичная структура – это расположение полипептидных цепей, входящих в состав отдельных субъединиц относительно друг друга, т.е. способ укладки и упаковки с образованием нативной конформации белка: ионные, водородные и дисульфидные связи.
2) При повышении температуры выше 42˚С водородные и гидрофобные связи разрываются → потеря нативной конформации, денатурация(это негидролитическое нарушение четвертичной, третичной и вторичной структуры с сохранением первичной структуры белка , сопровождающееся изменением его свойств)
3) Температура, при которой наблюдается максимальная активность ферментов, называется оптимальной.
Для большинства ферментов оптимальной температурой являетсятемпература от +35С — +45С.
Обратимая инактивация, когда после удаления денатурирующего агента или уменьшения его концентрации, белок может восстановить свою структуру, т.е. происходит ренатурация.
А после необратимой инактивации белок больше не сможет восстановить свою структуру.
2
Нейропептид головного мозга Leu-энкефалин имеет последовательность тир-гли-гли-фен-лей. Определите суммарный заряд молекулы при рН 3,0; 7,0; 11,0. В какой области рН лежит изоэлектрическая точка этого пептида? Алгоритм решения:
Написать формулу указанного пентапептида.
Определить к каким группам по химическому строению и свойствам относятся перечисленные аминокислоты

3
К нейропептидам относят пептиды, содержащиеся в головном мозге. Первые два представителя нейропептидов называются энкефалинами, были выделены из мозга животных в 75 году. Эти пептиды оказывают обезболивающее действие и используются как лекарственные средства. Охарактеризуйте этот пентапептид. Алгоритм решения:
Напишите структурную формулу метионин-энкефалина: Тир-Гли-Гли-Фен-Мет и обозначьте N и С концы пептида
Определите суммарный заряд пептида в нейтральной среде и направление его движения при электрофорезе
Какие цветные реакции будут положительными с этим пептидом

3) - метионин: +реакция Фоля (на содержание серосодержащих аминокислот), метод основан на способности серосодержащих аминокислот в щелочной среде при нагревании образовывать сульдид Na,который с плюмбитом Na даст черный осадок сульфида свинца;
- тирозин, фенилаланин +реакция Мульдера( ксантопротеиновая), метод основан на способности ароматических образовывать при взаимодействии с концентрированной HNO3 динитропроизводные соединения желтого цвета,которые в щелочной среде переходят в хиноидные структуры оранжевого цвета;
-тирозин +диазореакция Паули на циклические аминокислоты, метод основан на способности тирозина диазобензолсульфокислотой образовывать окрашенные в оранжево-красный цвет азосоединения.
4
Белки, осуществляющие транспорт молекул или ионов через мембрану, часто классифицируются как трансмембранные белки. Такие белки имеют в своей структуре область, заключенную в липидном слое биомембраны, и области, обращенные внутрь клетки (в цитоплазму) и во внеклеточное пространство. Охарактеризуйте такие белки. Алгоритм решения:
Предположите, какие аминокислоты должны преобладать в различных участках данного трансмембранного протеина
Приведите примеры аминокислот с неполярными и полярными радикалами
Объясните, в каком случае суммарный заряд белковой молекулы будет равен нулю
Аминокислоты в липидном слое биомембраны – неполярные или лишены заряда и протонированы (-СООН) или депротонированы (-NH2) , обращенные внутрь клетки (в цитоплазму) – асп, глу и С конец полипетидной цепи, и во внеклеточное пространство –арг, лиз и N конец полипептидной цепи.
Неполярные – гли, ала, фен и др., полярные – арг, лиз, глу, арг.
…
5
В моче больного фенилкетонурией обнаружены фенилаланин – 6мМ/л ( в норме 0,01мМ/л) и его метаболит – фенилпировиноградная кислота – 4,9 мМ/л ( в норме отсутствует). Почему в организме данного больного повышен уровень фенилалалина и его м етаболиты появляются в моче? Алгоритм решения:
При отсутствии какого фермента фенилаланин перестает превращаться в тирозин? Напишите эту реакцию
Назовите фермент, вышеуказанной реакции и его кофермент, витамины, необходимые для работы этого фермента
Какие рекомендации должен дать врач при выявлении новорожденного с фенилкетонурией и чем опасна поздняя диагностика этого заболевания?
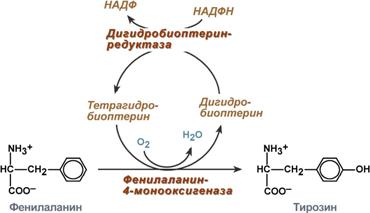
фенилаланин-4-гидроксилаза , Ко – тетрагидробиоптерин (Н4БП), НАДФН2 . Активность фермента зависит также от наличия Fe2+.
вит – С !
3) Главным способом лечения фенилкетонурии является (полностью исключают продукты, богатые белком и фенилаланином: мясо, рыбу, сыр, творог, яйца, бобовые и др. В пищевой рацион больных входят овощи, фрукты, соки, а также специальные малобелковые продукты – амилофены)
При фенилкетонурии характерны следующие фенотипические особенности: гипопигментация кожи, волос, радужной оболочки глаз, склеродермия, эпилептические приступы, задержка психоречевого развития, нередко отмечается микроцефалия.
Поздняя диагностика → олигофрения
6
В настоящее время в биохимических лабораториях для определения активности ферментов в биологических жидкостях человека используют автоматические биохимические анализаторы. Помогите лаборанту разобраться в реактивах, которые необходимо использовать для определения активности лактатдегидрогеназы (ЛДГ). Алгоритм решения:
