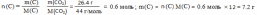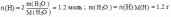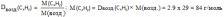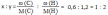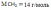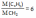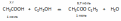- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
1.Задача
При сгорании 2.3г органического вещества образуется 26.4г оксида углерода (IV) и 10.8г воды. Относительная плотность по воздуху равна 2.9.
Дано: |
Решение: |
m(в-ва)= 8.4 г |
|
m(CO2) =26.4 г |
|
m(H2O) = 10.8 г |
|
Найти: молекулярную формулу |
|
|
Молекулярная формула: С6Н12 |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №34
Билет № 34
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Проделать реакции, характеризующие химические свойства уксусной кислоты.
Реактивы:
раствор С2Н5ОН
раствор NaOH
раствор СН3COOH
раствор Na2CO3
раствор FeCl3
раствор лакмуса
CaO
Mg
Оборудование:
штатив с пробирками,
спиртовка,
держатель для пробирок.
Ход работы
Уксусная кислота обладает общими химическими свойствами с неорганическими кислотами:
1) с активными металлами (магнием): 2СН3COOH + Mg (СН3COO)2Mg + H2↑
2) с основными оксидами: 2СН3COOH + CaO (СН3COO)2Ca + H2O
3) с гидроксидами металлов: СН3COOH + NaOH СН3COONa + H2O
4) вытесняет более слабые кислоты из их солей: СН3COOH + Na2CO3 СН3COONa + H2O + CO2
5) более сильные кислоты способны вытеснять уксусную кислоту из солей: CH3COONa + HCl CH3COOH + NaCl
6) диссоциирует в водных раствора – лакмус окрашивается в красный цвет:
СН3COOH СН3COO- + Н+
7) Качественная реакция на анион CH3COO- реакция с FeCl3. 2-3 капли анализируемого раствора помещают в пробирку, прибавляют 5 капель раствора с массовой долей FeCl3 10%, разбавляют водой в два раза и нагревают. Выпадает бурый осадок основного ацетата железа.
8) Реакция этерификации в присутствии серной кислоты:
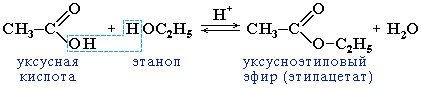
ЭТАЛОН ОТВЕТА К БИЛЕТУ №35
Билет № 35
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Вычислите, какая масса уксусной кислоты израсходуется на получение 0,7 моль этилового эфира уксусной кислоты.
Дано: |
Решение: |
n эфира = 0.7 моль |
|
Найти: |
n эфира = n(СН3СООН) = 0,7 моль |
m(СН3СООН) |
M (СН3СООН) = 88г/моль |
|
m(СН3СООН)=nxM=0.7x88=61.6 г |
|
Ответ: m(СН3СООН)=61.6 г |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №36
Билет № 36
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Пользуясь имеющимися реактивами, осуществите превращения:
CuSO4 → Cu(OH)2 → CuO
Проделать реакции, характеризующие химические свойства уксусной кислоты.
Реактивы:
раствор хлорида меди (II),
раствор гидроксида натрия.
Оборудование:
штатив с пробирками,
спиртовка,
держатель для пробирок.
Ход работы
Проделаем реакции по предложенной схеме:
CuSO4 Cu(OH)2 CuO
1. К раствору сульфата меди (II) надо прилить раствор щелочи:
CuCl2 + 2NaOH →Cu(OH)2↓ + 2NaCl
голубой осадок
Cu2+ + 2OH- Cu(OH)2
2. Полученный осадок нагреть. Образуется черный осадок CuO:
to
C
 u(OH)2
CuO + H2O
u(OH)2
CuO + H2O
ЭТАЛОН ОТВЕТА К БИЛЕТУ №37
Билет № 37
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания: