
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
1.Опыт:
Проведите реакции, подтверждающие качественный состав серной кислоты.
Реактивы:
раствор хлорида бария,
раствор метилового оранжевого,
раствор ласмуса,
раствор серной кислоты.
Оборудование:
штатив с пробирками
Ход работы
В растворе: H2SO4 = 2H+ + SO42-
Реактивом на ион водорода служит лакмус (красная окраска), метиловый оранжевый (розовая окраска)
Реактивом на сульфат-ион является ион бария: Вa2+ + SO42- = BaSO4↓
(белый осадок)
ЭТАЛОН ОТВЕТА К БИЛЕТУ №29
Билет № 29
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
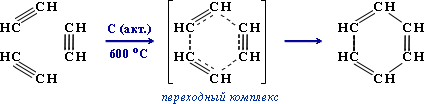
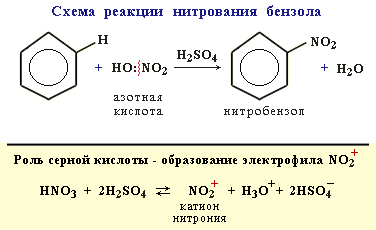
Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления: СаС2 → С2Н2 → С6Н6 → C6H5NО2 → C6H5NH2.
Дайте название каждого вещества.
1. СаС2 + 2Н2О → СН4 + Са(ОН)2
2.
3.
![]() 4.
4.
СаС2 – карбид кальция
С2Н2 – ацетилен
С6Н6 – бензол
C6H5NО2 – нитробензол
C6H5NН2 – анилин
ЭТАЛОН ОТВЕТА К БИЛЕТУ №30
Билет № 30
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Вычислите, какая масса гидроксида натрия образуется при взаимодействии 2,3 г натрия с водой.
Дано: |
Решение: |
m(NaOH) = 2.3 г |
|
Найти: |
|
m(NaOH) |
Ответ: m(NaOH) = 4 г |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №31
Билет № 31
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Получите углекислый газ и проведите реакции, характеризующие его химические свойства.
Реактивы:
СаСО3 (мрамор)
раствор ласмуса
раствор соляной кислоты
раствор Са(ОН)2 (известковая вода)
Оборудование:
штатив с пробирками
Ход работы
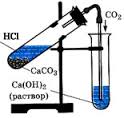
В лаборатории углекислый газ получают действием соляной кислоты на мрамор (СаСО3).
1. Получение углекислого газа:
СаСО3 + 2НCl = CaCl2 + H2O + CO2↑
2. Углекислый газ СО2 – кислотный оксид и может реагировать с водой, щелочами и основными оксидами.
2.1.Получающийся углекислый газ пропустим в пробирку с раствором лакмуса
 СО2
+ Н2О
↔ Н2СО3
СО2
+ Н2О
↔ Н2СО3
Цвет раствора становится красным. Окраска неяркая, так как угольная кислота слабая, т.к. неполностью диссоциирует на ионы.
2.2.Заменим пробирку-приемник на новую, содержащую
известковую воду (раствор Са(ОН)2). Наблюдается помутнение известковой воды от образования осадка карбоната СаСО3.
Наблюдаем, что полученный осадок быстро растворяется в избытке СО2, так как образуется растворимый гидрокарбонат кальция:
СаСО3 + Н2О + СО2 = Са(НСО3)2
ЭТАЛОН ОТВЕТА К БИЛЕТУ №32
Билет № 32
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Ацетилен получают взаимодействием карбида кальция с водой. Вычислите, какой объем ацетилена (н.у.) выделится при вступлении в реакцию 33,7 г. технического карбида кальция, содержащего 5% примесей.
Дано: |
Решение: |
m(CaC2)(техн.) = 33.7 г |
|
ωпримесей = 5 % |
1. Вычисляем массу чистого карбида кальция: (CaC2) = 100% - 5% = 95% без примесей m(CaC2) = (CaC2) х m(CaC2)(техн.) = 0.95 х 33,7 = 32 г
|
Найти: V(С2Н2) |
2 Ответ: V (C2H2) = 11.2 л |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №33
Билет № 33
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:

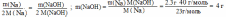
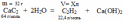
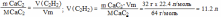 .
Вычисляем
объем выделившегося ацетилена:
.
Вычисляем
объем выделившегося ацетилена: