
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
1.Опыт:
Проведите реакции, подтверждающие характерные химические свойства кислот (на примере серной кислоты).
Реактивы:
раствор КOH,
раствор H2SO4
раствор BaCl2
раствор К2СО3
Zn
CuO
Оборудование:
штатив с пробирками
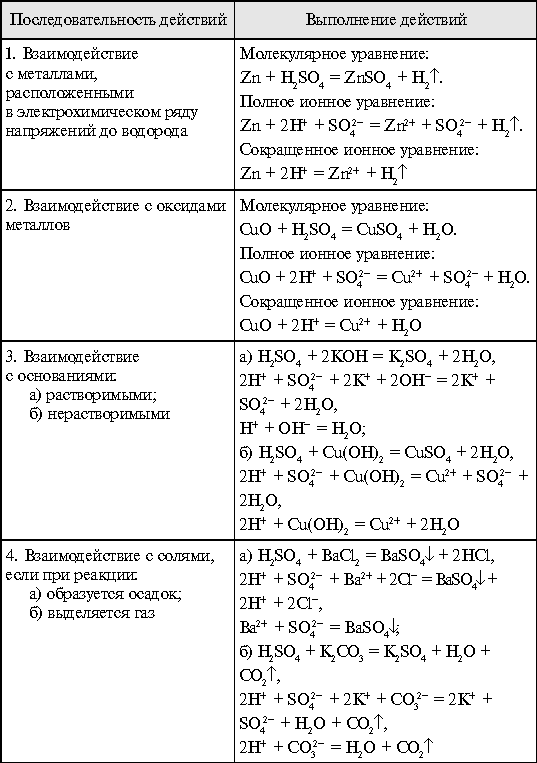
Диссоциация серной кослоты:
H2SO4 SO42- + 2H+
Окраска индикаторов: лакмус – красный.
ЭТАЛОН ОТВЕТА К БИЛЕТУ №19
Билет № 19
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
В раствор, содержащий 6,3 г азотной кислоты, добавили 4,8 г гидроксида кальция. Вычислите массу образовавшейся соли.
Дано: |
Решение |
m (HNO3) = 6.3 г |
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O |
m (Сa(OH)2= 4.8 г |
Находим количество вещества: |
Найти |
n(HNO3)=m(HNO3)/M(HNO3)=6.3 г/63г/моль=0.1моль |
m (соли) |
n(Ca(OH)2 = 4.8г/74г/моль = 0.065 моль (избыток) |
|
|
|
|
|
Ответ:m Ca(NO3)2 = 8.2 г |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №20
Билет № 20
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Вычислите, какая масса раствора фосфорной кислоты с массовой долей 80% потребуется для приготовления 2кг раствора с массовой долей 5%.
Дано: |
Решение: |
ω1(H3PO4) = 80% |
|
m2р-ра(H3PO4) = 2кг |
|
ω2(H3PO4) = 5% |
|
Найти: m1р-ра (H3PO4) |
Ответ:m1(р-ра) H3PO4 = 125 г |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №21
Билет № 21
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
К 250г раствора с массовой долей растворенного вещества 10 % добавили 150г воды. Определите массовую долю растворённого вещества в новом растворе.
Дано: |
Решение: |
m1(р-ра) = 250г |
|
ω1(р. в-ва) = 10% |
|
m(H2O) = 150г |
|
Найти: ω2(р. в-ва) |
|
|
Ответ: ω2=6.25% |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №22
Билет № 22
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Определите с помощью характерных реакций каждое из следующих органических веществ: глицерин, крахмал, белок
Реактивы:
спиртовой раствор J2
раствор CuSO4
раствор NaOH
Оборудование:
штатив с пробирками
1. Распознать эти три вещества можно, прежде всего, по внешнему виду: глицерин – сиропообразная жидкость, хорошо растворимая в воде, крахмал – твердое, белое вещество, не растворимое в холодной воде, белок образует с водой коллоидный раствор.
2. Затем следует проверить все три вещества на взаимодействие с йодом. При добавлении йода только крахмал дает синее окрашивание.
3. Глицерин и белок можно отличить друг от друга с помощью гидрокида меди (II), который нужно получить по реакции:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
голубой осадок
В пробирке с белком гидроксид меди (II) приобретает красно-фиолетовый цвет, а глицерин образует темно-синий раствор глицерата меди(II).
ЭТАЛОН ОТВЕТА К БИЛЕТУ №23
Билет № 23
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:









