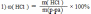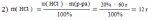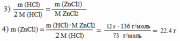- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
1.Задача
При сгорании 2,3 г органического вещества образовалось 1,12 л углекислого газа и 0,9 г воды. Плотность паров вещества по водороду равна 23. Выведите молекулярную формулу вещества.
Дано: m(СхНуОz) = 2,3 m(H2O) = 0,9 V(CO2) = 1,12 D(Н2) =23
|
Р Находим М вещества: Dводорода = Mr = 2 • 23. M = 46 г/моль. В 1 моль молекул СО2 содержится 1 моль атомов углерода. Молярный объем СО2 при н.у. равен 22,4 л/моль. Определим массу углерода в навеске вещества:
m(C) = = = 0,6 (г).
Вся масса водорода, содержавшаяся в неизвестном веществе, перешла в воду. Учитывая, что в 1 моль молекул воды содержится 2 моль атомов водорода, определим массу водорода в навеске вещества: m(H) =
Определим массу кислорода в навеске вещества: m(O) = mвещества – m(C) – m(H); m(O) = 2,3 – 0,6 – 0,1 = 1,6 (г). Находим число молей углерода, водорода и кислорода в веществе: ν(С) =
ν(Н) =
ν(О)
=
Найдем соотношение молей элементов в веществе: 0,05 : 0,1 : 0,1 = 1 : 2 : 2. СН2О2
Ответ: НСООН метановая кислота или муравьиная кислота.
|
Найти: СхНуОz - ? |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №16
Билет № 16
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Выведите молекулярную формулу органического вещества, если известно, что (C) = 48,65 %, (O) = 43,24 %, (H) = 8,11 %, а относительная плотность паров этого вещества по воздуху равна 2,55. Выведите молекулярную формулу вещества.
Дано: (C) = 48,65 % (O) = 43,24 % (H) = 8,11 % Dвозд(СхНyOz). =2,55
|
Решение: Находим Mr вещества по его плотности: Dвозд (вещества) = Mr / 29; Mr = 29 • D; Mr= 29 • 2,55 = 74; M = 74 г/моль. Определяем массы элементов в 1 моль вещества: m(C)
=
m(O)
=
m(H) =
Находим число молей атомов элементов: n(Э) = m(Э) / M(Э); n(C)
= m(C)/M(C)
= n(O)
= m(O) / M(O); n(O) =
n(H)
= m(H) / M(H); ν(H) =
x: y:z = n(C):n(H):(O) = 3:2:6 Молекулярная формула вещества С3Н6О2. |
Найти: СхНуОz - ? |
|
Ответ: С3Н6О2. |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №17
Билет № 17
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Вычислите массу соли, полученной взаимодействием цинка с 60г раствора соляной кислоты с массовой долей растворённого вещества ω(HCl) = 20%.
Дано: mр-ра(HCl) = 60г (HCl) = 20% |
Решение: Zn + 2HCl → ZnCl2 + H2↑ Находим массу HCl
Находим массу ZnCl2
Ответ: m(ZnCl2) = 22.4 г
|
Найти: m(ZnCl2) |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №18
Билет № 18
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания: