
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
1.Опыт:
Распознайте с помощью характерных реакций растворы глицерина и глюкозы.
Реактивы:
раствор NaOH,
раствор AgNO3
раствор CuCl2
Оборудование:
штатив с пробирками
Ход работы
В водном растворе: CuCl2 = Cu2+ + 2Cl-
реактив на хлрид ион – соль –нитрат серебра:
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
белый осадок
Ag+ + Cl- = AgCl
реактив на ион меди – гидроксид-ион:
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓
голубой осадок
Cu2+ + 2OH- = Cu(OH)2
ЭТАЛОН ОТВЕТА К БИЛЕТУ №11
Билет № 11
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Смешаны 25г соли и 35г воды. Определите массовую долю соли в растворе (
Дано: |
|
m(соли) = 25г |
|
m(H2O) = 35г |
|
Найти ω(соли) |
Ответ: ω(соли) = 41.67% |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №12
Билет № 12
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
С помощью характерных реакций распознать растворы трех неорганических веществ: хлороводородной кислоты, хлорида бария и хлорида натрия.
Реактивы:
раствор HCl
раствор H2SO4
раствор BaCl2
раствор NaCl
раствор лакмуса
Оборудование:
штатив с пробирками
Ход работы
1) из трех предложенных веществ кислую реакции среды имеет только раствор HCl
HCl H+ + Cl- pH < 7
Отливаем по 1 мл из каждой пробирки и добавляем раствор лакмуса
В пробирке № 1 наблюдаем красное окрашивание раствора
Вывод: в пробирке № 1 находится раствор HCl
2) определяем раствор BaCl2
Добавляем в каждую из оставшихся пробирок раствор H2SO4:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
белый «молочный» осадок
NaCl + H2SO4 → реакция не идет
Вывод:
в пробирке № 2 – раствор BaCl2
в пробирке № 3 – раствор NaCl
ЭТАЛОН ОТВЕТА К БИЛЕТУ №13
Билет № 13
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Найдите молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
![]()
1 .Вычислить
относительную молекулярную массу
Mr(CхHy)
по относительной плотности:
.Вычислить
относительную молекулярную массу
Mr(CхHy)
по относительной плотности:
![]()
2.Найдите индексы x и y
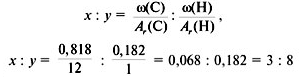
3. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Ответ: С3Н8
ЭТАЛОН ОТВЕТА К БИЛЕТУ №14
Билет № 14
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Распознайте с помощью характерных реакций три неорганических вещества. Растворы: сульфата калия, хлорида калия, карбоната калия.
Реактивы:
раствор хлорида калия,
раствор карбоната калия,
раствор сульфата калия,
раствор хлорида бария,
раствор нитрата серебра,
раствор соляной кислоты.
Оборудование:
штатив с пробирками,
Ход работы
1) качественной реакцией на ионы Cl- является реакция с нитратом серебра:
KCl + AgNO3 → AgCl↓ + KNO3
белый творожестый осадок
2) качественной реакцией на ионы SO42- является реакция с хлоридом бария:
K2SO4 + BaCl2 → BaSO4↓ + 2KCl
белый молочный осадок
3) К2СО3 – является солью слабой угольной кислоты, поэтому, при добавлении более сильной соляной кислоты происходит выделение газа:
К2СО3 + HCl → KCl + CO2↑ + H2O
ЭТАЛОН ОТВЕТА К БИЛЕТУ №15
Билет № 15
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:



