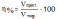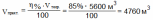- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Опыт:
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Опыт:
- •1.Задача
- •1.Задача.
- •1.Опыт:
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Задача.
- •1.Опыт:
- •Эталон ответа к билету №45 Билет № 45 задание №1
- •1. Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии.
- •2. Амины. Виды классификация аминов. Номенклатура первичных аминов. Изомерия аминов на примере бутиламина.
- •1.Задача.
ЭТАЛОН ОТВЕТА К БИЛЕТУ №1
Билет № 1
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1. Задача.
Вычислите количество вещества серной кислоты, которое надо взять, чтобы приготовить 5л раствора с концентрацией 0,1 моль/ л.
Дано: |
Решение: |
V(р-ра) = 5л С(H2SO4) = 0,1моль/л |
|
Найти: n(H2SO4) |
|
Ответ: n(H2SO4) = 0,5 моль
|
ЭТАЛОН ОТВЕТА К БИЛЕТУ №2
Билет № 2
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Составьте схему получения этанола из крахмала.
Запишите уравнения реакций и укажите условия осуществления этих реакций.
Решение:
(С6Н10О5)n → С6Н12О6 → CH3-CH2OH
Гидролиз крахмала ступенчатый. Протекает при нагревании в кислой среде.
В пищеварительном тракте гидролизуется под действием ферментов.
![]()
(С6Н10О5)n + nН2О → nС6Н12О6
Глюкоза способна подвергаться спиртовому брожению:
C6H12O6![]() 2CH3-CH2OH+2
CO2↑
2CH3-CH2OH+2
CO2↑
ЭТАЛОН ОТВЕТА К БИЛЕТУ №3
Билет № 3
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
Проделайте реакции, характерные для глюкозы.
Реактивы:
раствор глюкозы,
раствор хлорида меди (II),
раствор гидроксида натрия.
Оборудование:
штатив с пробирками,
спиртовка,
держатель для пробирок.
Ход работы
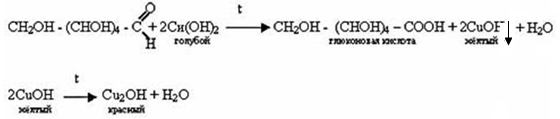
В формуле глюкозы содержатся пять гидроксильных групп (-ОН) – глюкоза является многоатомным спиртом, поэтому для глюкозы характерна реакция с гидроксида меди (II):
Получаем Cu(OH)2: CuCl2 + NaOH → Cu(OH)2↓ + H2O
К полученному осадку добавляем раствор глюкозы:
происходит растворение осадка Cu(OH)2 и цвет раствора изменяется до ярко синего
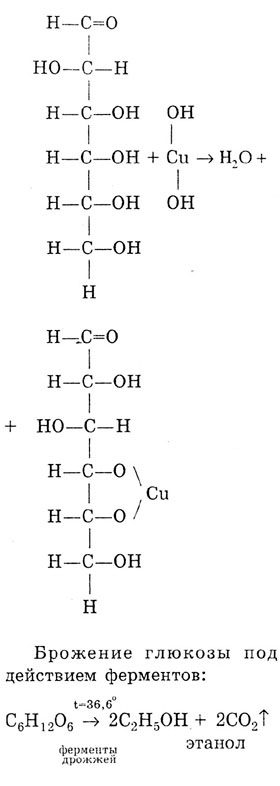
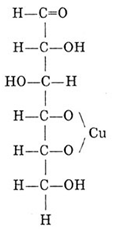
Нагреваем пробирку – происходит реакция по альдегидной группе – появляется красное окрашивание:
ЭТАЛОН ОТВЕТА К БИЛЕТУ №4
Билет № 4
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Задача
Вычислить, какой объем (н.у.) сернистого газа можно получить при сжигании 0,8 т. серы, если выход продукта реакции составляет 85% от теоретического.
Дано: m(S) = 0,8 г (SO2) = 85% |
Решение: 0,8 г х л S + O2 → SO2 32г/моль 22,4 моль/л 1.Теоретический выход продукта реакции (SO2)
р
2 рассчитываем по формулам:
Ответ: V (SO2) = 4760 м3
|
Найти: V(SO2) |
ЭТАЛОН ОТВЕТА К БИЛЕТУ №5
Билет № 5
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:
1.Опыт:
С помощью характерных реакций определите каждое из следующих веществ: K2CO3, NH4Cl, CuCl2 (в твердом виде).
Реактивы:
раствор гидроксида натрия,
раствор соляной кислоты.
Оборудование:
штатив с пробирками,
Ход работы
1. CuCl2 можно определить по зеленоватому цвету.
Для доказательства надо взять пробы всех трех веществ, растворить их в воде (см.табл. растворимости) и прилить раствор щелочи.
1 .1.
K2CO3
+ NaOH →
.1.
K2CO3
+ NaOH →
1.1.CuCl2 + NaOH = Cu(OH)2↓ + 2NaCl
голубой осадок
1.3. NH4Cl + NaOH = NH3↑ + H2O + NaCl (t0C)
Аммиак можно узнать по запаху или по тому, что влажная фенолфталеиновая бумажка, поднесенная к выделяющемуся газу, становится малиновой.
2. К2СО3 – является солью слабой угольной кислоты, поэтому, при добавлении более сильной соляной кислоты, происходит выделение газа:
К2СО3 + HCl → KCl + CO2↑ + H2O
ЭТАЛОН ОТВЕТА К БИЛЕТУ №6
Билет № 6
ЗАДАНИЕ №1
Текст задания:
1.
2.
ЗАДАНИЕ №2
Текст задания:



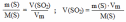 ассчитываем
по формулам:
ассчитываем
по формулам: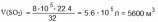 .Практический
выход продукта реакции (SO2)
.Практический
выход продукта реакции (SO2)