
-
Гидросфера и ее границы.
-
Гидросфера - водная оболочка Земли, представляющая совокупность всех водных объектов планеты: океанов, морей, рек, озер, болот, ледников, снежного покрова, подземных вод.
-
В состав гидросферы также входит вода в атмосфере, почвенная влага, вода живых организмов и вода находящаяся в связанном состоянии (кристаллизационная вода).
-
Гидросфера имеет нижнюю и верхнюю границу в литосфере. Она проходит по так называемой поверхности Мохоровичича. Верхняя граница располагается в верхних слоях атмосферы.Какие аномальные свойства воды Вы знаете.
-
Основные глобальные проблемы гидросферы.
-
Эвтрофикация водоемов - повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов естественного или антропогенного происхождения.
-
Обогащение водоема биогенными элементами (N, Р и др.), поступающими со сточными водами, а также с поверхностным стоком с удобряемых полей, приводит к “цветению” воды и к резкому ухудшению ее качества
-
Гидрологический цикл.
Гидрологический цикл в природе включает процессы: испарения воды с поверхности водоемов, конденсации водных паров в атмосфере, выпадения осадков, фильтрации через почву; проникновение в подземные водоносные пласты; всасывание, транспорт и транспирацию воды растениями, включение воды в биохимические процессы во всех живых организмах
-
Пресные воды гидросферы.
Количество составляет всего лишь 2,7% общего объема воды на Земле, причем очень малая ее доля (всего 0,36%) имеется в легкодоступных для добычи местах. Большая часть пресной воды содержится в снегах и пресноводных айсбергах, находящихся в районах в основном Южного полярного круга. Годовой мировой речной сток пресной воды составляет 37,3 тыс. кубических километров. Кроме того, может использоваться часть подземных вод, равная 13 тыс. кубическим километрам. К сожалению, большая часть речного стока в России, составляющая около 5000 кубических километров, приходится на малоплодородные и малозаселенные северные территории. При отсутствии пресной воды используют соленую поверхностную или подземную воду, производя ее опреснение или гиперфильтрацию: пропускают под большим перепадом давлений через полимерные мембраны с микроскопическими отверстиями, задерживающими молекулы соли
-
Формирование состава природных вод.
По характеру воздействия:
-
Физико-географические (рельеф, климат и т.п.);
-
Геологические (вид горных пород, гидрогеологические условия;
-
Биологические (деятельность живых организмов);
-
Антропогенные (состав сточных вод, состав твердых отходов);
-
Физико- химические (химические свойства соединений, кислотно- основные и окислительно-восстановительные условия и др.).
-
Главные анионы и катионы.
-
Na+ , Ca2+, Mg2+ и K+ называют главными катионами,
-
HCO3- , SO42- и Cl- - главными анионами природных вод.
-
Минерализация природных вод.
Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ, которые находятся именно в виде солей. Единицы измерения г×л-1 (грамм на литр в минус первой степени)
К числу наиболее распространенных относятся неорганические соли
• бикарбонаты
• хлориды
• сульфаты кальция, магния, калия и натрия
• небольшое количество органических веществ, растворимых в воде
классификация по солесодержанию
• менее 0,2 г/л ультрапресная
• 0,2-0,5 пресная
• 0,5-1 с относительно повышенной минерализацией
• 1-3 солоноватая
• 3-10 соленая
• 10-35 с повышенной соленостью
• 35-50 переходная к рассолам
• 50-400 рассолы
• более 400 в природе не встречаются
-
Жесткость природных вод.
Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Единицы измерения Ж – моль/куб. м
Ж = [Са2+]*f (Ca) /M (Ca) + [Mg2+]*f (Mg) /M (Mg)
Ж = [Са2+]/ 20,04 + [Mg2+]/ 12,156
[Са2+] и [Mg2+] в мг/л
Ж-моль/куб. м

-
Щелочность природных вод.
Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода.
Эта способность называется щелочностью воды и определяется экспериментально при титровании пробы воды сильной кислотой, обычно HCl, в присутствии фенолфталеина (рН перехода окраски 8,3) и затем метилоранжа (рН перехода краски 4,5)
Щ = [HCO3 - ] +2 [CO32- ] +[OH-] (моль/л)
Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод являются ионы HCO3-
-
Основные причины и этапы закисления озер.
В нормальном водоеме,
Щ =1 ммоль/л рН =7,8-8,3
Несмотря на поступление кислых осадков, рН практически не меняется. Ионы гидрокарбоната, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+:
НСО3- + Н+ = Н2О + СО2
Процесс закисления:
Первый этап.
Щ=0,1 ммоль/л Обычно рН =7-8.
В период интесивного поступления кислых дождей рН снижается до рН = 5,5
Второй этап
Щ – менее 0,1 ммоль/л
рН воды обычно не поднимается выше 5,5 в течение всего года (отсутствует контакт с карбонатными породами);
О таких водоемах обычно говорят как об умеренно кислых
Третий этап закисления
Щ = 0; рН водоемов стабилизируется на значениях рН<5 (обычно рН=4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения в основном представлены в водоемах растворами слабых органических кислот, имеющими рН<5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение рН в водоеме.
-
Окислительно-восстановительная способность природных вод.
{CH2О} + О2 = СО2 + Н2О
В связи с отсутствием, по условию примера, дополнительного поступления кислорода, максимальное количество органического вещества, которое может быть окисленно в воде будет определяться содержанием кислорода в воде, которое будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии приземным воздухом это количество составит
[С(кисл.)] = К Г(кисл.) * Р (кисл.)= 8,3 мг/л
Окислительно-восстановительное равновесие в природных водоёмах определяется, в основном, двумя процессами:
-фотосинтезом,
-бактериальным разложением органического вещества.
В результате фотосинтеза неорганические соединения, СО2 и НСО3-, образуют органический углерод и кислород:
СO2 + hν → Сорганич + O2
В отсутствие фотосинтеза атмосферный кислород расходуется на окисление органического вещества до полного исчезновения кислорода.
ОКИСЛЕНИЕ МЕРТВОЙ ОРГАНИКИ
1 молекула фитопланктона -138 О2
-
Стратификация природных водоемов, причины и последствия.
СТРАТИФИКАЦИЯ ВОДОЕМОВ - Разделение водоема на слои при температурной стратификации Верхний слой – ЭПИЛИМНИОН Средний слой - Зона термоклина Нижний слой – гиполимнион
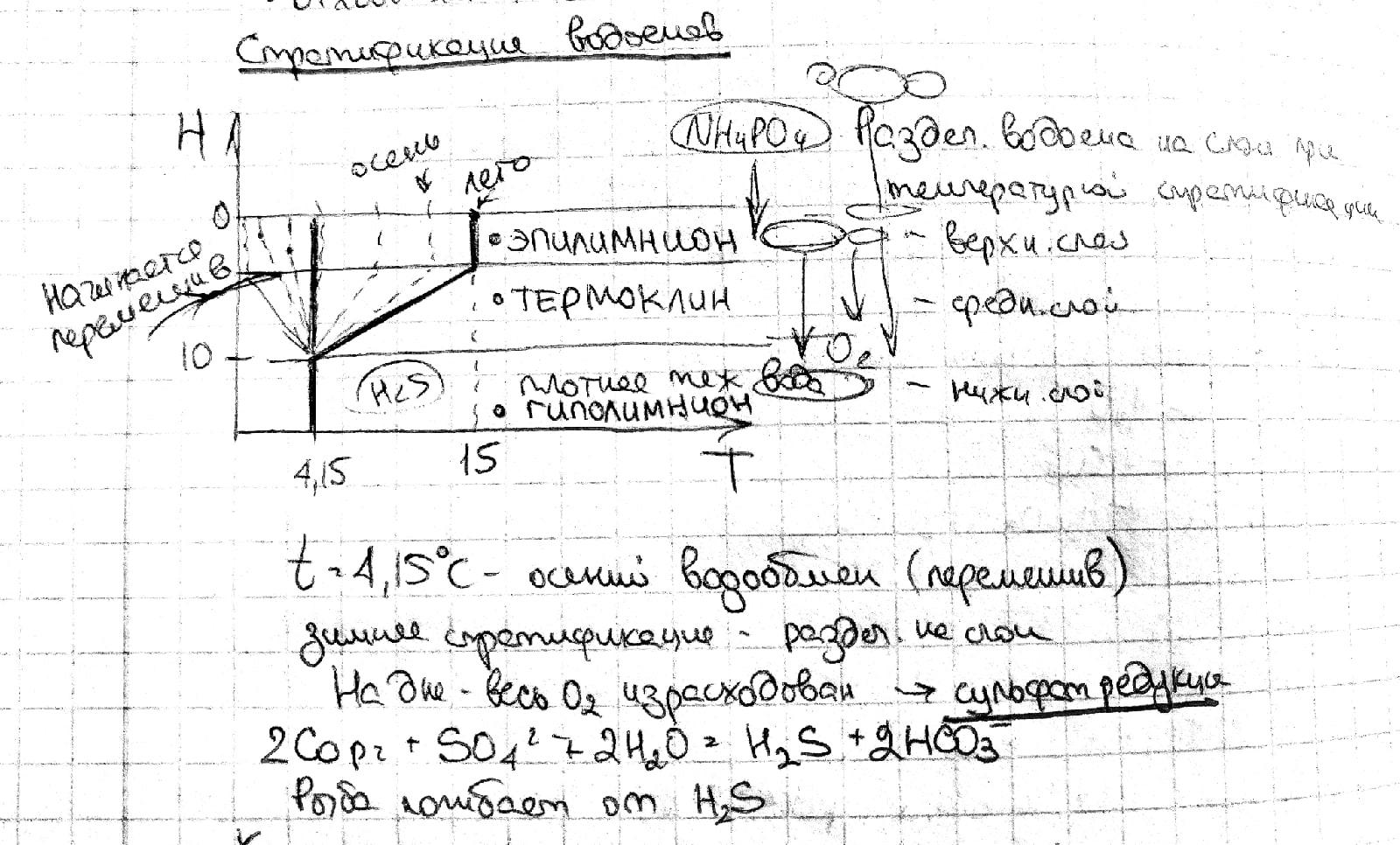
-
Эвтрофикация водоемов.
повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов естественного или антропогенного происхождения.
Обогащение водоема биогенными элементами (N, Р и др.), поступающими со сточными водами, а также с поверхностным стоком с удобряемых полей, приводит к “цветению” воды и к резкому ухудшению ее качества.
-
Окислительно-восстановительная буферность природных водоемов. Превращение органических соединений в анаэробных условиях.
Под кислотно-основной буферностью природных вод понимается их способность противостоять изменению рН и поддерживать его величину в определенных пределах.
В поддержании постоянного значения рН природных вод важную роль играют компоненты кислотности и щелочности, принцип действия которых определяется наличием двух взаимосвязанных равновесных систем: диссоциации и гидролиза.
Рассмотрим это на примере наиболее распространённых в природе карбонатных систем, которые в пресных водоёмах и создают, в основном, буферность:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
2СаСО3 + 2Н2О ↔ Са(НСО3)2 + Са(ОН)2
СО32- + Н2О ↔ НСО3- + ОН-
Анаэробное разложение. При отсутствии кислорода воздуха разложение органического вещества осуществляется анаэробными бактериями. При анаэробном разложении протекают процессы брожения, денптрнфикацип, восстановления сульфатовВ результате реакции сохраняется часть органических веществ, после разложения которых образуются органические кислоты или спирты, углекислота и аммиак. Для полного разложения органического вещества требуется больше времени, чем при аэробном разложении. В анаэробных условиях лигнин, воски и смолы почти не разлагаются.
-
Изменения содержания кислорода в воде озер, океана, Черного моря в зависимости от глубины погружения.
Кислород довольно быстро реагирует с сероводородом, окисляя его до сульфатов, и убивает анаэробные бактерии, производящие сероводород. Поэтому растворенный кислород, быстро расходуясь на окисление сероводорода, присутствует в Черном море только в поверхностном слое. Ниже 100 - 300 м, в сероводородной зоне, обитают только анаэробные бактерии да некоторые виды морских червей.
-
Каким и почему должен быть при отсутствии антропогенного влияния рН: а) тмосферных осадков;б) поверхностных водоемов?
А) 5,6
Б)При равновесии с карбонатными породами рН поверхностных вод должен составлять рН=8,3
-
Строение и состав литосферы.
Литосфе́ра (от греч. λίθος — камень и σφαίρα — шар, сфера) — твёрдая оболочка Земли. Состоит из земной коры и верхней части мантии, до астеносферы, где скорости сейсмических волн понижаются, свидетельствуя об изменении пластичности пород.
При переходе от земной коры к внутренней оболочке (B) происходит скачкообразное изменение скорости распространении сейсмических волн. Эта граница - поверхность Мохоровича
Слои B и C отличаются друг от друга и от слоя D скоростью распространения сейсмических волн

