- •Методические указания
- •«Химические источники электрического тока. Гальванические элементы»
- •Введение
- •Правила техники безопасности
- •Теоретическая часть химические источники электрического тока Механизм возникновения электродного потенциала
- •Факторы, от которых зависит величина электродного потенциала
- •Типы электродов
- •Гальванические элементы
- •Концентрационные элементы
- •Промышленные источники тока
- •Экспериментальная часть
- •Содержание
Гальванические элементы
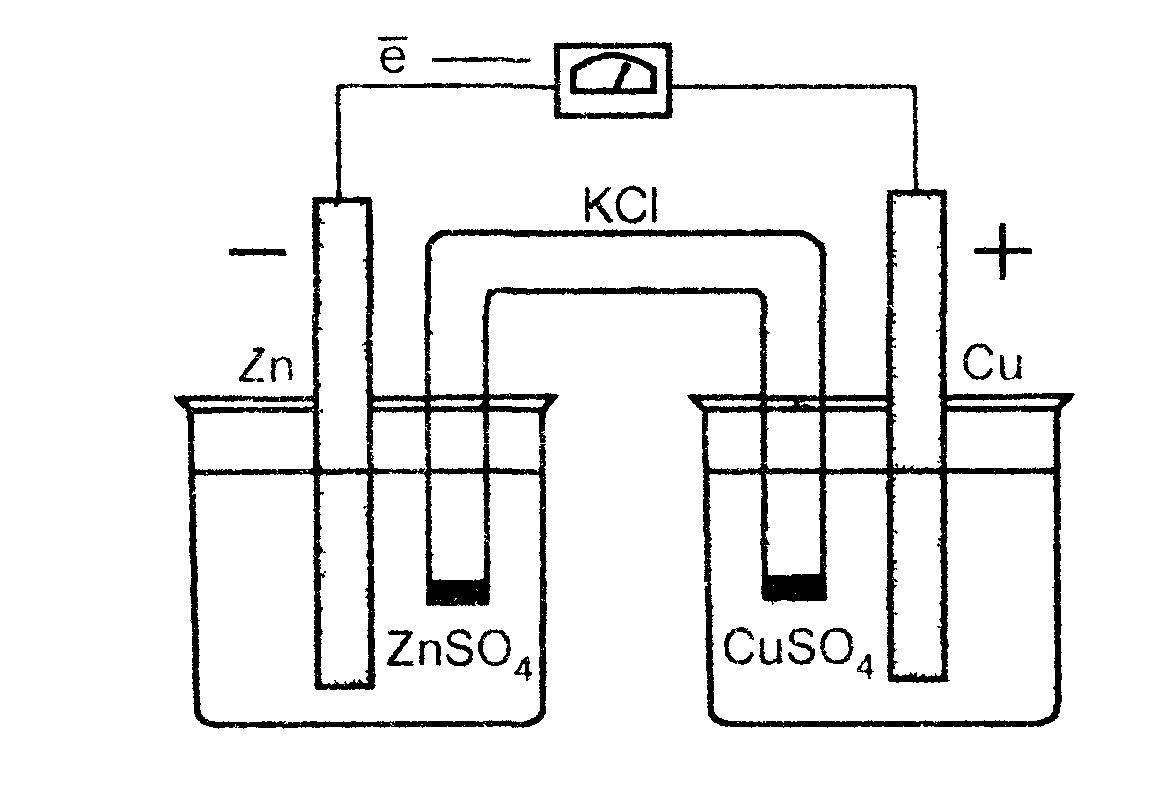
Гальванический элемент представляет собой электрохимическую систему, состоящую из двух электродов (любого типа), растворы которых соединены с помощью солевого мостика. Рассмотрим гальванический элемент, состоящий из двух электродов первого рода: цинкового и медного. На рис. 2. представлена схема такого элемента.
Рис.2. Гальванический элемент Даниеля-Якоби |
Растворы сульфатов цинка и меди соединены между собой солевым мостиком - стеклянной трубкой, заполненной раствором хлорида калия. Солевой мостик препятствует смешиванию растворов, проводит электрический ток. Пока цепь разомкнута, на каждом из электродов существуют равновесия: Zn- 2ē Zn2+ Сu - 2ē Сu2+
|
Поскольку цинк является металлом имеющим наиболее электроотрицательный потенциал, чем медь ( Е0Zn / Zn2+ = -0,76 В, Е0 Cu / Cu2+ = 0,34 В), первое равновесие по сравнению со вторым смещено вправо, следовательно, на цинковом электроде имеется избыток электронов. Соединим металлические пластины проводником. Электроны будут перемещаться с цинковой пластины на медную - в цепи пойдет электрический ток, равновесие на электродах нарушится. В соответствии с принципом Ле Шателье, на электродах начнутся процессы, способствующие восстановлению равновесия (т. е. появлению на цинковом электроде избытка электронов):
А (-) Zn 0 - 2ē Zn 2+ окисление
К (+) Сu 2+ + 2ē Сu 0 восстановление
Таким образом,
В любом замкнутом гальваническом элементе на отрицательном электроде, называемом анодом, происходит окисление, а на положительном электроде – катоде - восстановление.
Поскольку цепь замкнута, избыточные электроны будут перетекать на медную пластину и т. д. До тех пор, пока цепь будет замкнута, цинковая пластина будет растворяться, на медной будет осаждаться металлическая медь. Равновесие на электродах не установится, в цепи будет протекать ток. Просуммируем процессы, протекающие на электродах в замкнутом гальваническом элементе:
Zn + Сu2+ = Zn2+ + Сu
или Zn + СuSО4 = ZnSО4 + Сu
Суммарная электрохимическая реакция называется токообразующей. Рассмотренный гальванический элемент называется элементом Даниэля - Якоби. В прошлом веке он широко использовался в качестве источника постоянного тока. Сокращенное обозначение элемента Даниэля-Якоби: А (-) Zn | ZnSО4 || СuSО4 | Cu (+) К
Подобным образом обозначают любые гальванические элементы. При этом следует помнить, что слева принято указывать электрод с более отрицательным потенциалом.
Итак,
Гальванический элемент - это система, в которой происходит
самопроизвольная окислительно – восстановительная реакция
(ΔG< 0), энергия которой превращается в электрическую энергию.
Гальванический элемент является химическим источником электрического тока.
Основной характеристикой гальванического элемента является его электродвижущая сила (ЭДС) или ∆Е, которая представляет собой разность электродных потенциалов в исходный момент работы элемента. ЭДС всегда является величиной положительной.
Чтобы рассчитать величину ЭДС, необходимо вычесть из более положительного электродного потенциала величину более отрицательного потенциала. В нашем примере при концентрации ионов цинка и меди в растворах равных 1 г/ ион-л:
∆Е = Е0 Cu / Cu2+ – Е0Zn / Zn2+ = 0,34 – ( - 0,76) = 1,1 В (7)