
- •Лабораторная работа № 6
- •Ход работы:
- •Все опытные и табличные данные записывают в таблицу.
- •Лабораторная работа № 7
- •Теоретическое обоснование работы.
- •Ход работы:
- •Вывод: Лабораторная работа №8
- •Теоретическое обоснование:
- •Ход работы:
- •Определение температуры кипения
- •Вычерчивание диаграммы (т-с) с кривыми пара и жидкости
- •Лабораторная работа № 9
- •Теоретическое обоснование работы.
- •Лабораторная работа №10
- •Теоретическое обоснование работы.
- •Ход работы:
- •Очистка золей
- •Лабораторная работа № 11
- •Теоретическое обоснование работы.
- •Ход работы:
Определение температуры кипения
Для определения температуры кипения и получения конденсата применяется прибор Свитославского( состоит из сосуд для кипячения, термометра, холодильника, пробки, пробирки для отбора пробы) чтобы ртутный столбик термометра был полностью погружён в исследуемый раствор.
Для устранения сильного охлаждения весь прибор окружается асбестовым цилиндром. Температура отсчитывается с точностью до 0,1 градусов Цельсия. Холодильник устроен таким образом, что он может вращаться для того ,чтобы, с одной стороны, можно было при обратном холодильнике устанавливать температуру кипения смеси, с другой, чтобы при поставленному внизу холодильнике можно было перегонять небольшое количество жидкости, достаточное для определения состава пара путём анализа конденсата.
 Нагревают
раствор до достижения постоянной
температуры кипения, затем поворачивают
холодильник и отгоняют в бюкс с притёртой
пробкой 5-6 капель конденсата. Если при
взятии пробы температура заметно
изменяется, отмечают начальную и конечную
температуры: состав оставшейся жидкости
будет отвечать конечной температуре,
в то время как состав конденсата
приблизительно будут соответствовать
начальной температуре. Получаются точки
кипения исследуемых растворов.
Нагревают
раствор до достижения постоянной
температуры кипения, затем поворачивают
холодильник и отгоняют в бюкс с притёртой
пробкой 5-6 капель конденсата. Если при
взятии пробы температура заметно
изменяется, отмечают начальную и конечную
температуры: состав оставшейся жидкости
будет отвечать конечной температуре,
в то время как состав конденсата
приблизительно будут соответствовать
начальной температуре. Получаются точки
кипения исследуемых растворов.
Вычерчивание диаграммы (т-с) с кривыми пара и жидкости
Откладывают на горизонтальной оси состав в мольных процентах, а на вертикальной оси температуру кипения. Каждой температуре будет соответствовать две точки, одна из них относится к составу пара, другая к составу жидкой фазы. Соединяя соответствующие точки, получим две кривые, одна из них будет кривой пара, другая кривой жидкости.
Таблица 1.
№№ пп |
Наименование вещества |
Мольная доля |
Мольные проценты |
Коэффициент преломления |
Температура кипения |
||
раствора |
конденсата |
раствора |
конденсата |
||||
|
|
|
|
|
|
|
|
Лабораторная работа № 9
Тема: «Определение рН раствора потенциометрическим титрованием по методу нейтрализации»
Цель работы: ознакомление с работой рН - метра и определение рН раствора по методу нейтрализации.
Оборудование и реактивы:
рН - метр со стеклянным электродом
0,1 раствор соляной кислоты
0,1 н раствор NaОН
Магнитная мешалка
Бюретка на 50 мл.
Стаканчик на 150 мл.
Вода дистиллированная
Магнитик
Пипетка на 10 мл.
Цилиндр на 100 мл.
Воронка
Теоретическое обоснование работы.
Потенциометрическое титрование - один из важных, часто применяемых на практике методов физико-химического анализа. Этот вид анализа широко используется в лабораторной практике. Он заключается в том, что точку эквивалентности при титровании определяют по резкому изменению разности потенциалов пары электродов, погруженных в анализируемый раствор.
Величина потенциала индикаторного электрода зависит от концентрации тех ионов, которые определяют потенциал. Если при титровании в результате реакции нейтрализация этих ионов уменьшается, соответствующим образом изменится и потенциал. Наибольшее изменение потенциала произойдет в момент полного связывания ионов определяющих потенциал, т.е. в точке эквивалентности.
Таким образом, электрохимический потенциал служит в данном случае индикатором в процессе титрования.
Момент окончания реакции, т.е. точка эквивалентности, должен быть хорошо заметен визуально. В точке эквивалентности должно происходить заметное изменение потенциала индикаторного электрода или скачек потенциала.
В стаканчик на 150 мл. отмеряем пипеткой 10 мл. 0„1н раствора соляной кислоты. Сюда же приливаем 100 мл. дистиллированной воды. Смесь перемешиваем магнитной мешалкой. В анализируемый раствор погружаем электродную пару и после добавления каждой порции титранта измеряем рН. При этом необходимо интенсивное размешивание, поскольку концентрация ионов во всем растворе должна быть одинакова. При титровании состав раствора меняется и в соответствие с новым составом раствора устанавливается новый равновесный электродный потенциал. Это происходит быстро, но не мгновенно, и после добавления каждой порции рабочего раствора нужно выдержать его в течение некоторого времени, помешивая, после чего начать измерение электродного потенциала.
Титрование ведем 0,1н раствора NаОН.
 Приливаем
раствор щелочи по 0,1 мл.
Приливаем
раствор щелочи по 0,1 мл.
Титрование проводим дважды, Сначала определяем приближенный расход раствора едкого натра, добавляя порциями гю 1 мл.
При повторном титровании раствора добавляется сначала большими порциями (по 1 мл.), а по мере приближения к точке эквивалентности - по 0.1 мл.
Результаты титрования вносят в таблицу и затем строят кривую потенциометрического титрования
№ |
Объём щёлочи |
Е |
ΔЕ |
ΔV |
ΔЕ/ ΔV |
1. |
|
|
— |
— |
— |
2. |
|
|
|
|
|
3. |
|
|
|
|
|
4. |
|
|
|
|
|
5. |
|
|
|
|
|
6. |
|
|
|
|
|
7. |
|
|
|
|
|
8. |
|
|
|
|
|
9. |
|
|
|
|
|
10. |
|
|
|
|
|
11. |
|
|
|
|
|
12. |
|
|
|
|
|
13. |
|
|
|
|
|
14. |
|
|
|
|
|
15. |
|
|
|
|
|
16. |
|
|
|
|
|
17. |
|
|
|
|
|
18. |
|
|
|
|
|
19. |
|
|
|
|
|
20. |
|
|
|
|
|
21. |
|
|
|
|
|
22. |
|
|
|
|
|
23. |
|
|
|
|
|
24. |
|
|
|
|
|
25. |
|
|
|
|
|
26. |
|
|
|
|
|
27. |
|
|
|
|
|
28. |
|
|
|
|
|
29. |
|
|
|
|
|
30. |
|
|
|
|
|
31. |
|
|
|
|
|
32. |
|
|
|
|
|

По данным титрования строим график зависимости рН от объёма титранта. На оси абсцисс откладываем величину объёма добавленного рабочего раствора (в мл.), а на оси ординат - величину рН. В точке эквивалентности плавный характер кривой изменяется. В зависимости от величины скачка потенциала на кривой появляется изгиб (при небольшой величине скачка) или ступенька. Отрезок оси абсцисс от нуля до точки, соответствующей скачку потенциала и есть объём рабочего раствора, израсходованный на титрование до точки эквивалентности (график, изображенный на рис.1).
Для графика, изображенного на рис.2 на оси абсцисс откладываем величину объёма добавленного рабочего раствора (в мл.), а на оси ординат величину. Пик кривой соответствует точке эквивалентности.
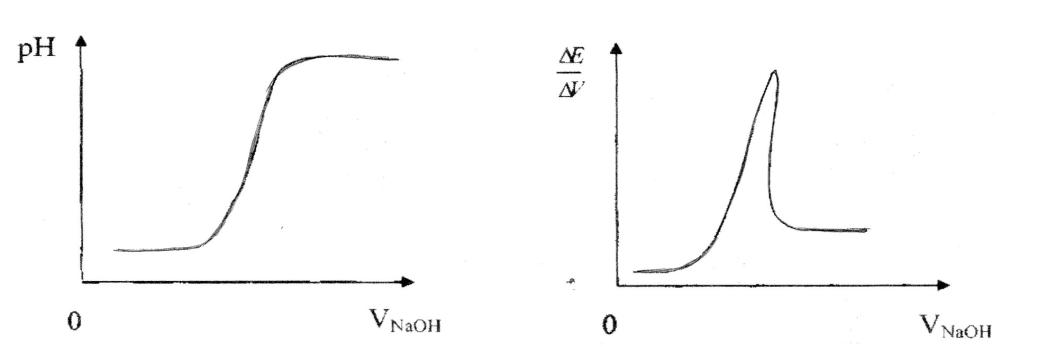
На этих графиках вы видите кривые потенциометрического титрования. Содержание соляной кислоты в анализируемом растворе равно:
Nx=(V*N)/ Vx
где - концентрация анализируемого раствора в г/экв
Vx - объём анализируемого раствора в мл.
N - концентрация рабочего раствора в г.экв/л
V - объём рабочего раствора, израсходованный на титрование до точки
эквивалентности, в мл.
Потенциометрическое титрование в общем случае требует больших за времени, чем обычное титрование с цветным индикатором.
Поэтому потенциометрический метод применяют только в тех случаях, к невозможно выполнить анализ обычными приемами объёмного анализа.
Вывод: ознакомилась с работой рН - метра и научилась определять рН раствора методу нейтрализации.

