
- •Лабораторная работа № 6
- •Ход работы:
- •Все опытные и табличные данные записывают в таблицу.
- •Лабораторная работа № 7
- •Теоретическое обоснование работы.
- •Ход работы:
- •Вывод: Лабораторная работа №8
- •Теоретическое обоснование:
- •Ход работы:
- •Определение температуры кипения
- •Вычерчивание диаграммы (т-с) с кривыми пара и жидкости
- •Лабораторная работа № 9
- •Теоретическое обоснование работы.
- •Лабораторная работа №10
- •Теоретическое обоснование работы.
- •Ход работы:
- •Очистка золей
- •Лабораторная работа № 11
- •Теоретическое обоснование работы.
- •Ход работы:
Лабораторная работа № 6
Тема: «Определение молекулярного веса растворенного вещества криоскопическим методом»
Цель работы: Опытным путем определить понижение температуры замерзания раствора и вычислить молекулярный вес растворенного вещества.
Оборудование и реактивы:
Широкая пробирка с боковым отростком
Кожух для широкой пробирки
Термометр Бекмана
Бюкс
Воронка
Лед + NаСl
Вода дистиллированная
Пипетка на 10 мл.
Цилиндр на 100 мл.
Мочевина
Весы
Мешалка
Стакан
Колба коническая на 100 мл.
Теоретическое обоснование работы.
Если в каком либо растворителе растворить некоторое количество твердого вещества, то вследствие понижения упорности пара растворить над раствором, наблюдается понижение температуры затвердевания раствора по сравнению с температурой затвердевания чистого растворителя. Понижение температуры затвердевания Тз равно разности Тз растворителя - Тз раствора = Тз. И зависит от концентрации раствора, для не электролитов:
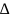 Тз=Ез*С
Тз=Ез*С
где Ез - молекулярное понижение температуры затвердевания, или криоскопическая постоянная.
С - молярная концентрация раствора (моль/1000 растворителя).
Обозначим массу взятого растворителя G, а массу растворенного вещества m, тогда
Тз =

где М - молекулярный вес растворенного вещества.
Определяем опытным путем дТз из формулы (1) можно найти молекулярный вес вещества в данном растворе.
M =
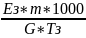

Ход работы:
Для определения температуры затвердевания растворителя пользуются прибором, изображенным на рис.
О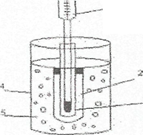 н
состоит из широкой пробирки с боковым
отростком 1, вставленной в более широкую
пробирку-кожух 2. Во внутреннюю пробирку
на пробке Бекмана 3. Пробирку с кожухом
помещают широкий стакан 4, заполненной
охладительной смесью 5.В пробирке 1
имеется металлическая мешалка. В сухую
пробирку 1 отбирают пипеткой или цилиндром
30 см Н20 и погружают термометр
Бекмана таким образом, чтобы резервуар
со ртутью был полностью погружен в
жидкость но не касался дна и стенок
пробирки. Боковой отросток пробирки
закрывают пробкой. Вставляют пробирку
в кожух и погружают в охладительную
смесь. Осторожно помешивая жидкость в
пробирке мешалкой, следят за показаниями
термометра. Когда температура достигает
одного градуса, перемешивают воду
мешалкой до появления кристалликов
льда. При этом температура повышается.
Температурой замерзания чистого
растворителя следует считать ту
температуру, которая устанавливается
после этого перемешивания. Повторяют
такое измерение 2-3 раза. Для этого
пробирку 1 вынимают, нагревают рукой до
исчезновения кристаллов, снова помещают
в охладительную смесь и определяют Тз
растворителя. Отчет температуры проводят
с помощью лупы. В бюксе на аналитических
весах отвешивают навеску (мочевина) в
пределах 5,4 г. Открыв боковой отросток
пробирки, вводят навеску, закрывают
пробкой, осторожно помешивая, добиваются
полноты растворения мочевины в воде.
Аналогично описанному определению
находят температуру затвердевания
полученного раствора Тз, повторяя
измерения 2-3 раза.
н
состоит из широкой пробирки с боковым
отростком 1, вставленной в более широкую
пробирку-кожух 2. Во внутреннюю пробирку
на пробке Бекмана 3. Пробирку с кожухом
помещают широкий стакан 4, заполненной
охладительной смесью 5.В пробирке 1
имеется металлическая мешалка. В сухую
пробирку 1 отбирают пипеткой или цилиндром
30 см Н20 и погружают термометр
Бекмана таким образом, чтобы резервуар
со ртутью был полностью погружен в
жидкость но не касался дна и стенок
пробирки. Боковой отросток пробирки
закрывают пробкой. Вставляют пробирку
в кожух и погружают в охладительную
смесь. Осторожно помешивая жидкость в
пробирке мешалкой, следят за показаниями
термометра. Когда температура достигает
одного градуса, перемешивают воду
мешалкой до появления кристалликов
льда. При этом температура повышается.
Температурой замерзания чистого
растворителя следует считать ту
температуру, которая устанавливается
после этого перемешивания. Повторяют
такое измерение 2-3 раза. Для этого
пробирку 1 вынимают, нагревают рукой до
исчезновения кристаллов, снова помещают
в охладительную смесь и определяют Тз
растворителя. Отчет температуры проводят
с помощью лупы. В бюксе на аналитических
весах отвешивают навеску (мочевина) в
пределах 5,4 г. Открыв боковой отросток
пробирки, вводят навеску, закрывают
пробкой, осторожно помешивая, добиваются
полноты растворения мочевины в воде.
Аналогично описанному определению
находят температуру затвердевания
полученного раствора Тз, повторяя
измерения 2-3 раза.
При разности Тз растворителя и Тз раствора вычисляют Тз. Расчет молекулярного веса растворенного вещества производят по формуле (2), предварительно найдя Ез для воды по таблице. Массу растворителя находят по формуле:
G = V
*
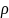
 где:
где:
V - объём растворителя,
р — плотность растворителя.
