
- •Методические указания к выполнению курсовой и расчетной работы По курсу
- •7.090510 "Теплоэнергетика"
- •7.090521 "Тепловые электрические станции"
- •7.000008 "Энергетический менеджмент"
- •1 Определение теплота сгорания газообразного топлива
- •4 Определение температуры газовых смесей
- •5 Определение температуры горения
- •Расчет температуры горения
- •Теоретическая температура горения
- •Находим температуру, соответствующую значениям
- •Состав продуктов сгорания:
- •Р ис.12. График для посчёта температуры
- •Механические топки
- •Пылеугольные топки . . . . . . . . . . . . . . . . . . .1,20 – 1,25
- •Находим температуру, соответствующую значениям
- •Методические указания к выполнению курсовой и расчетной работы По курсу
- •7.090510 "Теплоэнергетика"
- •7.090521 "Тепловые электрические станции"
- •7.000008 "Энергетический менеджмент"
- •8 3066, Донецк, Артема, 58
Теоретическая температура горения
Достижению калориметрической температуры препятствует прежде всего то, что СО2 и Н2О — продукты горения всякого топлива, независимо от его исходного состояния — являются сложными химическими соединениями, разлагающимися при высоких температурах. Этот процесс диссоциации продуктов сгорания, количественно иллюстрируемый уравнениями
2СО2![]() 2СО
+ О2—
136440 ккал (77)
2СО
+ О2—
136440 ккал (77)
2Н2О 2Н2 + О2 — 115 620 ккал, (78)
по существу является обратным процессу горения окиси углерода СО и водорода Н2. Таким образом, основные реакции горения суть обратимые реакции, для которых, как и для всяких химических реакций, между отдельными составными частями фазы или их физико-химическими характеристиками устанавливается некоторая зависимость, определяемая величиной так называемой константы равновесия.
Для интересующих нас процессов диссоциации СО2 и Н2О эти константы равновесия определяют величину отношений парциальных давлений исходных веществ и продуктов диссоциации. Для реакции диссоциации угольного ангидрида постоянная равновесия выражается следующим образом:
 (79)
(79)
и для диссоциации водяного пара:
 (80)
(80)
Величина постоянной равновесия зависит от температуры; теоретически эта зависимость определяется формулой Вант-Гоффа, практически же приходится пользоваться эмпирическими формулами, построенными по типу выражения, получаемого при интегрировании формулы Вант-Гоффа.
Для диссоциации СО2 формула Саккура устанавливает следующую зависимость постоянной равновесия от температуры:
![]() (81)
(81)
Для водяного пара:
![]() (82)
(82)
Если в качестве меры диссоциации принять отношение количества распавшегося вещества к количеству первоначального взятого (так называемый коэффициент диссоциации), то можно легко установить связь между константой равновесия и коэффициентом диссоциации.
Если обозначить:
а —коэффициент диссоциации СО2 или Н2О;
![]() —
число
молей избыточного кислорода на 1
моль диссоциирующего
газа;
—
число
молей избыточного кислорода на 1
моль диссоциирующего
газа;
z —число молей газов, не принимающих участия в реакции, отнесенное к 1 молю диссоциирующего газа;
Р — общее давление системы, то
![]() (85)
(85)
Для диссоциации чистых СО2 и Н2О в условиях, когда v = 0 и z= 0, имеем:
![]() (84)
(84)
Последние
уравнения в сочетании с предыдущими
зависимостями
![]() от
Т
дают
уравнения равновесия, при помощи которых
устанавливается связь между коэффициентом
диссоциации
от
Т
дают
уравнения равновесия, при помощи которых
устанавливается связь между коэффициентом
диссоциации
и температурой.
Так как в результате диссоциации в продуктах сгорания появляются СО и Н2 наряду со свободным кислородом, то естественно, что количество сообщенного продуктам сгорания тепла меньше величины теплотворности топлива на величину теплоты трения продуктов диссоциации СО и Н2. В результате температура горения, определенная с учетом диссоциации, будет ниже температуры, определяемой без учета этого явления.
Температуру, до которой могут быть нагреты продукты сгорания топлива при частичной диссоциации угольного ангидрида и водяного пара, условимся называть теоретической температурой горения. Эта температура всегда ниже калориметрической. Теоретическая температура в большей или меньшей степени приближается к калориметрической. Из уравнений для определения константы равновесия следует, что с повышением температуры константа равновесия уменьшается; следовательно, уменьшается парциальное давление недиссоциировавшей двуокиси углерода и водяного пара. В результате расхождение между калориметрической температурой, определяемой в предположении, что диссоциация отсутствует, и теоретической, учитывающей ее влияние, увеличивается. Если при определении температуры продуктов сгорания исходить из равенства
 (85).
(85).
то влияние диссоциации скажется и в уменьшении Q и в изменении m. Обе эти величины зависят от степени диссоциации, т. е. от величины а — коэффициента диссоциации. Так как в уравнении равновесия и в уравнении калориметрическом величины а и t одни и те же, то для определения теоретической температуры горения получаются два уравнения с двумя неизвестными — температурой и коэффициентом диссоциации.
Наиболее просто решение этой системы достигается графически— путем отыскания координат точки пересечения двух кривых, построенных для каждого из уравнений. Первая кривая характеризует зависимость температуры от степени диссоциации; вторая дает зависимость коэффициента диссоциации от температуры.
Задача решается в следующем порядке. Задаваясь различными значениями коэффициента диссоциации, определяют соответствующую данному значению коэффициента диссоциации температуру продуктов сгорания. По полученным точкам строят в осях а —t кривую. Затем, задаваясь значениями температур, определяют из уравнения равновесия значения коэффициентов диссоциации. На той же сетке наносят новые данные. Пересечение двух кривых дает значения t и а, удовлетворяющие обоим уравнениям.
Такой метод решения предложен акад. Н С. Курнаковым [14] и рекомендуется проф. Б. В. Старком как единственно возможный для случая, когда в продуктах сгорания присутствуют одновременно СО2, Н2О и О2.
Иллюстрируем примером этот метод определения теоретической температуры, используя некоторые данные из предыдущего расчета горения бензола.
В указанном расчете были определены:
начальное теплосодержание продукта сгорания io = 900 ккал/нм3,
2)состав продуктов сгорания, если диссоциация отсутствует.
3)
калориметрическая температура горения
![]() =2219
.
=2219
.
% Доли
СО, 16,1 0,161
Н2О 8,1 0,081
N2 75,8 0,758
100,0 100,0
Для определения теоретической температуры необходимо учитывать, что в продуктах сгорания одновременно присутствуют СО2 и Н2О, так что должно установиться равновесие между пятью составными частями:
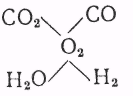
Следовательно, при решении задачи необходимо учитывать наличие трех неизвестных — температуры t m, коэффициента диссоциации СО2 — х и коэффициента диссоциации Н2О — у. Трем неизвестным соответствуют и три уравнения:

Последнее уравнение можно заменить новым, получающимся путем вычитания второго из третьего и деления полученного равенства на 2,
![]()
Левая
часть этого равенства не что иное, как
логарифм постоянной
равновесия
![]() реакции
реакции
СО+Н2О = СО2 + Н2
![]()
Значение
этой постоянной, как и логарифмов
постоянных
![]() и
и
![]() приведены
в табл. 33.
приведены
в табл. 33.
Состав продуктов горения при диссоциации СО2 и Н2О выразится следующим образом:
СО2 0,161 (1-х) =0,161—0,101 х
СО……………0,161 х =0,161 х
Н2О 0,081 (1— у) . . =0,031—0,081 у
Н2 0,081 у =0,081 у
О2…………………..0,5-0,161 x+0,5-0,081 у =0,08х + 0,04 у
N2…………………….0,758 =0,758
Σ=1,0+0,08х+0,04у
В свою очередь объемная теплоемкость водяного пара ниже теплоемкости двуокиси углерода. Теплоемкость двуокиси углерода, водяного пара, азота и других газов возрастает с повышением температуры; при этом наиболее быстро с повышением температуры возрастает теплоемкость двуокиси углерода. Теплоемкость водяного пара и особенно теплоемкость азота и других двухатомных газов возрастает с повышением температуры значительно медленнее. Так, средняя теплоемкость двуокиси углерода в температурном интервале от 0 до 2000° в 1,55 раза больше теплоемкости при 0°; средняя теплоемкость водяного пара в данном температурном интервале в 1,30 раза больше теплоемкости при 0°, а теплоемкость азота в интервале температур от 0 до 2000° только в 1,15 раза превышает теплоемкость при 0°
Средняя
теплоёмкость газов
![]() от
от![]() до t
до t
![]() ,
по Юсти
,
по Юсти
t |
СО2 |
Н2О |
воздух |
N2 |
О2 |
Н2 |
СО |
SО2 |
СH4 |
C2 H4 |
t |
0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400 2500 2600 2700 |
0.384 0.409 0.431 0.449 0.464 0.480 0.492 0.503 0.513 0.522 0.530 0.538 0.544 0.550 0.556 0.561 0.565 0.569 0.573 0.577 0.580 0.583 0.586 0.589 0.591 0.593 0.595 0.597 |
0.356 0.358 0.362 0.367 0.372 0.378 0.384 0.390 0.397 0.403 0.410 0.416 0.422 0.427 0.433 0.439 0.444 0.450 0.455 0.460 0.464 0.469 0.473 0.478 0.481 0.485 0.489 0.492
|
0.310 0.311 0.318 0.315 0.318 0.321 0.324 0.328 0.331 0.334 0.337 0.340 0.343 0.345 0.347 0.350 0.352 0.354 0.355 0.357 0.358 0.359 0.360 0.362 0.363 0.365 0.366 0.367 |
0.310 0.311 0.312 0.314 0.316 0.319 0.322 0.324 0.327 0.331 0.334 0.337 0.340 0.342 0.345 0.347 0.349 0.351 0.353 0.354 0.356 0.357 0.359 0.360 0.362 0.363 0.364 0.365 |
0.312 0.314 0.319 0.324 0.329 0.334 0.339 0.343 0.347 0.350 0.355 0.356 0.359 0.362 0.364 0.366 0.368 0.370 0.372 0.374 0.376 0.377 0.379 0.380 0.382 0.383 0.385 0.386 |
0.306 0.309 0.310 0.311 0.311 0.312 0.313 0.314 0.315 0.316 0.318 0.319 0.321 0.323 0.325 0.327 0.328 0.330 0.332 0.334 0.336 0.338 0.340 0.342 0.343 0.345 0.347 0.349 |
0.310 0.311 0.312 0.315 0.318 0.321 0.324 0.328 0.332 0.335 0.338 0.341 0.344 0.346 0.348 0.350 0.352 0.354 0.356 0.358 0.359 0.361 0.362 0.364 0.365 0.366 0.368 0.369 |
0.415 0.435 0.453 0.469 0.484 0.496 0.506 0.515 0.523 0.530 0.536 0.541 0.546 0.550 0.554 0.557 0.560 0.563 0.565 0.567 0.570 0.572 0.573 0.575 0.577 0.578 0.580 0.581 |
0.368 0.386 0.419. 0.451. 0.480 0.509 0.537 0.563 0.588 0.610 0.632 - - - - - - - - - - - - - - - - - |
0.447 0.503 0.556 0.605 0.650 0.691 0.729 0.762 0.799 0.824 0.851 - - - - - - - - - - - - - - - - -
|
0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400 2500 2600 2700 |
Однако несмотря на столь значительное различие в значениях теплоемкостей СО2, Н2О и N2, теплоемкости продуктов сгорания углерода и водорода в стехиометрическом объеме воздуха близки между собой на всем температурном интервале от 0 до 2100. Малое различие в теплоемкости продуктов сгорания углерода и водорода в воздухе объясняется тем, что при горении углерода по уравнению
С + О2 + 3,76N2 = СО2 + 3,76 N2
Средняя теплоёмкость газов от до t ,
t |
СО2 |
Н2О |
N2 |
О2 |
воздух |
СО |
Н2 |
СH4 |
C2 H6 |
C2 H4 |
0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400 2500 |
0.3821 0.4061 0.4269 0.4449 0.4609 0.4750 0.4875 0.4988 0.5090 0.5181 0.5263 0.5338 0.5407 0.5469 0.5526 0.5578 0.5626 0.5671 0.5712 0.5750 0.5785 0.5818 0.5848 0.5876 0.5902 0.5926 |
0.3569 0.3595 0.3636 0.3684 0.3739 0.3797 0.3857 0.3920 0.3984 0.4050 0.4115 0.4180 0.4244 0.4306 0.4366 0.4425 0.4481 0.4537 0.4589 0.4639 0.4686 0.4735 0.4779 0.4822 0.4864 0.4903 |
0.3092 0.3095 0.3104 0.3121 0.3144 0.3161 0.3201 0.3233 0.3265 0.3295 0.3324 0.3352 0.3378 0.3404. 0.3427 0.3449 0.3470 0.3490 0.3508 0.3525 0.3541 0.3557 0.3571 0.3585 0.3598 0.3610 |
0.3119 0.3147 0.3189 0.3239 0.3290 0.3339 0.3384 0.3426 0.3463 0.3498 0.3529 0.3557 0.3584 0.3608 0.3631 0.3653 0.3673 0.3693 0.3712 0.3730 0.3748 0.3764 0.3781 0.3797 0.3813 0.3828 |
0.3098 0.3106 0.3122 0.3146 0.3174 0.3207 0.3240 0.3274 0.3306 0.3338 0.3367 0.3395 0.3422 0.3447 0.3470 0.3492 0.3513 0.3532 0.3551 0.3568 0.3585 0.3600 0.3615 0.3629 0.3643 0.3655 |
0.3103 0.3109 0.3122 0.3145 0.3174 0.3207 0.3242 0.3277 0.3311 0.3343 0.3374 0.3403 0.3430 0.3455 0.3479 0.3501 0.3522 0.3541 0.3559 0.3576 0.3592 0.3607 0.3621 0.3634 0.3647 0.3659 |
0.3049 0.3083 0.3098 0.3103 0.3110 0.3117 0.3124 0.3134 0.3145 0.3159 0.3174 0.3191 0.3208 0.3227 0.3246 0.3266 0.3285 0.3304 0.3324 0.3343 0.3362 0.3388 0.3398 0.3416 0.3433 0.3451
|
0.3702 0.3922 0.4201 0.4505 0.4814 0.5112 0.5400 0.5677 0.5957 0.6216 0.6447 0.6655 0.6838
|
0.5278 0.5959 0.6627 0.7271 0.7902 0.8485 0.9023 0.9521 0.9986 01.0418 1.0818 1.1187 1.1525 |
0.4363 0.4925 0.5452 0.5960 0.6415 0.6839 0.7227 0.7571 0.7901 0.8196 0.8472 0.8731 0.8963 |
Значение постоянной К3 и логарифмов постоянный К1 и К2
Температура t, 0C |
Lg K1 (2CO2 2H2+O2) |
Lg K2 (2H2O 2H2+O2) |
K3 (CO+H2O= =CO2+H2) |
Температура t, 0C |
Lg K1 (2CO22CO2+O2) |
Lg K2 (2H2O 2H2+O2) |
K3 (CO+H2O= =CO2+H2) |
1000 1100 1200 1300 1400 1500 1600 1700 |
13,975 12,220 10,696 9,363 8,185 7,134 6,204 5,347 |
14,557 13,044 11,732 10,606 9,564 8,659 7,846 7,113
|
1,871 2,095 2,420 2,820 3,240 3,620 4,220 4,621
|
1800 1900 2000 2100 2200 2300 2400 2500 |
4,578 3,878 3,236 2,648 2,105 1,602 1,135 0,701 |
6,448 5,842 5,287 4,777 4,306 3,870 3,465 3,089
|
5,039 5,481 5,970 6,522 7,160 7,918 8,835 9,961 |
Cледовательно,
K1
=
 ,
,
K1
=
![]() .
.
K3
=
![]() ,
,
K3
=
![]() .
.
Отсюда
y
=
![]() .
.
Задаёмся температурой равновесия 2000, для которой
lg K1 = 3,236 и K3 = 5,970
Принимаем x = 0,180, тогда
y
=
![]()
lg
K1
= lg
![]() ,
,
lg
K1
= lg
![]() = lg 1335,0 = 3,1260,
= lg 1335,0 = 3,1260,
Принимаем x = 0,16, тогда
y
=
![]() = 0,032,
= 0,032,
lg
K1
= lg
![]() = lg 1999,0 = 3,2990
= lg 1999,0 = 3,2990
Для интерполяции находим:
3,299 – 3,126 = 0,173
3,236 – 3,126 = 0,110
0,173 : 0,02 = 0,110 : s,
откуда
s
=
![]() = 0,126
= 0,126
х = 0,18 – 0,0126 = 0,1674
у
=
![]() = 0,0325
= 0,0325
Находим температуру, соответствующую
х = 0,1674 и у = 0,0325
Состав продуктов горения:
м3 %
СО2 0,161 (1-0,1674) . . . . . . . . . . . . . . . . . . . . . . . . . = 0,1338 13,75
СО 0,161 0,1174 . . . . . . . . . . . . . . . . . . . . . . . . . . . = 0,0280 2,76
Н2О 0,081 (1- 0,0325) . . . . . . . . . . . . . . . . . . . . . . . . = 0,0783 7,70
Н2 0,081 0,0325 . . . . . . . . . . . . . . . . . . . . . . . . . . . = 0,027 0,27
О2 0,5 0,161 0,1674 + 0,5 0,081 0,0325 . . . . = 0,017 1,67
N2 0,758 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .= 0,758 74,45
= 1,0178 100,00
Тепло для нагрева продуктов сгорания:
горение
бензола. . . . .
![]() ккал
ккал
диссоциация СО2 . . . . - 3045 0,0280 = - 84
Н2О. . . . – 2580 0,0027= - 7
793 ккал
Теплосодержание i продуктов сгорания при t = 2000 .
СО2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,1315 1159 = 152,2 ккал
СО . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0276 718,4 = 19,9 »
Н2О . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0770 929,0 = 71,6 »
Н2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0027 672,0 = 1,8 »
О2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0167 751,5 = 12,5 »
N2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,7445 712,2 = 531,0 »
i = 789.0 ккал/м3
Теплосодержание i продуктов сгорания t = 2100
СО2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,1315 1224 = 166,0 ккал
СО . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0276 758,1 = 20,9 »
Н2О . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0770 985,8 = 76,0 »
Н2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0027 709,4 = 1,9 »
О2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0167 791,8 = 13,2 »
N2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,7445 750,6 = 559,5 »
i = 837,5 ккал/м
t
= 2000+![]()
100 = 2000 + 8 = 2008.
100 = 2000 + 8 = 2008.
Так как температура получилась выше 2000 , то искомая температура выше 2000 и ниже 2100.
Задаёмся температурой равновесия 2100. Для этой температуры
lg K1 = 2,648
K3 = 6,522.
Принимаем х = 0,240, тогда
y
=
![]() = 0,046
= 0,046
lg
K1
= lg
(
![]() )
= 2,689
)
= 2,689
Принимаем х = 0,250, тогда
y
=
![]() = 0,049,
= 0,049,
lg
K1
= lg
![]()
= 2,622
= 2,622
2,689 – 2,622 = 0,067
2,648 – 2,622 = 0,026
0,067 0,01 = 0,026 s,
откуда
s
=
![]() = 0,0039
= 0,0039
х = 0,25 – 0,0039 = 0,2461,
у
=
![]() = 0,0475.
= 0,0475.
