
- •3. Виды перкуссии: по технике, по цели, по громкости.
- •4. Свойства перкуторных звуков
- •8.2. Тупой перкуторный звук, причины, диагностическое значение
- •8.3. Тимпанический перкуторный звук, диагностическое значение
- •9.2.1. Изменения положения нижних границ в патологии
- •9.3. Подвижность нижнего легочного края в норме
- •9.3.1. Изменения подвижности нижнего легочного края в патологии
- •2. Диффузное ослабление:
- •I тон называется систолическим, так как выслушивается в начале систолы. По механизму образования он состоит из 4-х компонентов:
- •Который тон первый?
- •1. Шумы, выслушиваемые при наиболее часто встречающихся клапанных пороках сердца.
- •3. Функциональные шумы.
- •1. Чрезмерного разрушения эритроцитов и повышенной выработки билирубина — гемолитическая или надпечёночная желтуха;
- •2. Нарушения улавливания клетками печени билирубина и связывания его с глюкуроновой кислотой — паренхиматозная;
- •1. Первичная, эссенциальная аг
- •2. Симптоматическая аг
- •1. Синдром нарушения (недостаточности) пищеварения (малъдигестии)
- •1. Нарушение полостного пищеварения - это "диспепсия" в широком смысле слова.
- •2. Нарушение преимущественно пристеночного пищеварения.
- •3. Эндокринные нарушения:
- •1. Синдром портальной гипертензии
- •II. Геморрагический синдром. Три основных фактора лежат в основе геморрагического синдрома при спн:
- •7. Затруднение и болезненность мочеиспускания при отёке наружных половых органов;
- •Причины опн:
- •I стадия — начальная
- •II стадия — олиго-анурическая
- •III стадия — стадия восстановления диуреза
- •IV стадия — стадия выздоровления
3. Функциональные шумы.
Это понятие подразумевает отсутствие органической патологии сердца. Различение органических и функциональных шумов - один из наиболее сложных вопросов, которые приходится решать при аускультации сердца. Обычно перечисляют следующие признаки функциональных шумов [2]:
в большинстве случаев они систолические;
шумы не постоянны, могут возникать и исчезать при различном положении тела, после физической нагрузки, в разных фазах дыхания;
наиболее часто они выслушиваются над легочным стволом, реже – над верхушкой сердца;
шумы непродолжительны, по характеру они мягкие, дующие;
шумы обычно выслушиваются на ограниченном участке и не проводятся далеко от места возникновения;
функциональные шумы не сопровождаются другими признаками поражения клапанов (увеличение отделов сердца, изменение тонов и др.).
Все изложенные признаки, взятые изолированно, встречаются и при органических шумах. Кроме того, такие понятия, как «в большинстве случаев», «наиболее часто», «обычно», не могут быть критериями при диагностике. Врач всегда должен быть готов к тому, что имеет дело с исключением. Примерами исключений могут быть: функциональный пресистолический шум Флинта при аортальной недостаточности, непостоянные органические шумы при миксоме предсердия, вегетациях на клапанах при септическом эндокардите, незначительная зона проведения органического шума митрального стеноза, усиление его при физической нагрузке и т. д.
Вывод о том, что шум функциональный, делается только после всестороннего исследования больного, поэтому шестой пункт является самым главным. Необходимо лишь добавить, что, исключив органическое поражение сердца, надо объяснить происхождение функционального шума.
Трудности могут возникнуть при выслушивании хордальных шумов, когда вибрирует попадающая в поток крови аномальная хорда. При этом методами осмотра, пальпации и перкуссии сердца не выявляется патологических изменений, нет и изменения тонов. Явно органический шум можно принять за функциональный, если он не имеет особого характера, присущего иногда хордальным шумам, – музыкального оттенка, характерного для звука, имеющего выраженную частотную однородность. Абсолютную уверенность в хордальном происхождении шума дает эхокардиографическое исследование.
Наиболее часто встречающиеся функциональные шумы.
Анемический шум обусловлен существенным ускорением кровотока при компенсаторном усилении работы сердца. Он возникает во время систолы в легочных артериях, так как в области бифуркации легочного ствола имеются большие возможности в появлении вихревого кровотока в отличие от аорты, где поток крови плавно поворачивается по ее дуге. Этот шум выслушивается на различном по площади участке предсердечной области с точкой максимальной громкости в зоне легочной артерии. Громкие анемические шумы имеют широкую зону проведения и часто слышны над всем сердцем. Они начинаются после первого тона, имеют дующий характер. Интенсивность шума понижается к концу систолы.
Иногда анемический шум лучше выслушивается или имеет вторую точку максимальной громкости над левым желудочком, что, по-видимому, обусловлено увеличением объема и скорости митральной регургитации у тех пациентов, у которых физиологическая регургитация была до развития анемии.
Скоростной систолический шум появляется у быстро растущих детей и подростков, когда отходящие от сердца сосуды (аорта и легочный ствол) имеют относительно небольшой просвет, что приводит к существенному ускорению кровотока и повышению в нем вихревого компонента. В настоящее время этот шум часто называют физиологическим. Такие шумы могут иногда выслушиваться вдоль крупных сосудов далеко от сердца (в сонных, подключичных, подмышечных и даже плечевых артериях). Эти шумы ослабевают и совсем исчезают после прекращения быстрого роста пациента, когда диаметр аорты и легочного ствола достигает оптимальной величины и скорость кровотока нормализуется.
Внесердечные шумы.
Шум трения перикарда. Перикардиальное трение возникает при трении негладких листков эпикарда и перикарда вследствие отложения на их поверхности фибрина при перикардите. Громкость и характер шума вариабельны. Он может быть едва слышимым и напоминать шелест шелковой ткани, листьев бумаги, царапанье, крепитацию. Более грубый и громкий шум походит на хруст снега. Так как шум связан со смещением сердца во время систолы и диастолы, в нем может быть три составляющих, совпадающих с систолой предсердий, систолой желудочков и с протомезодиастолой. Не все они могут быть слышимы. Шум часто воспринимается как посторонний звук (он такой и есть на самом деле), мешающий аускультации. Лучше всего он выслушивается над тупостью сердца, не прикрытой лёгкими. Иногда его слышно лишь в положении пациента стоя или сидя с наклоном вперед, это бывает при наличии небольшого экссудата. При наклоне вперед сердце соприкасается с перикардом, вытесняя имеющуюся между ними жидкость. Полезно выслушивать лежащего на животе больного, когда он приподнимет грудную клетку, опираясь на локти.
Плевроперикардиальный и плеврокардиальный шумы. Обычно врач встречается с плеврокардиальным шумом. Это шум трения плевры, который возникает или усиливается во время сокращения или расслабления желудочков, так как изменение объема сердца приводит к местному изменению объема прилежащих к сердцу участков легкого и смещению париетального и висцерального листков плевры относительно друг друга. Этот шум усиливается на вдохе, ослабевает или даже исчезает при задержке дыхания. Характерно отсутствие его над абсолютной тупостью сердца. Лучше всего он слышен чуть кнаружи от нее на стороне плеврита или плевропневмонии.
Истинный плевроперикардиальный шум, возникающий от трения негладких поверхностей наружной стороны перикарда и париетальной плевры, по-видимому, большая редкость, так как перикард и париетальная плевра обычно соединены между собой слоем рыхлой соединительной ткани.
Кардиопульмональный (пульмокардиальный) шум. Везикулярный шум, усиливающийся в ритме сердечных сокращений вследствие дополнительного расширения участка легкого, примыкающего к сердцу, во время систолы желудочков (рис. 9). Он чаще слышен слева вдоль границы относительной тупости сердца, иногда в межлопаточном пространстве, исчезает при задержке дыхания.
Сухие хрипы, имитирующие внутрисердечные шумы. В редких случаях единичный сухой хрип в мелком бронхе выслушивается в ритме сердечной деятельности и очень напоминает музыкальный внутрисердечный шум. Он значительно лучше слышен во время вдоха или только во время выдоха. Механизм его образования аналогичен таковому при пульмокардиальном шуме, только возникает не везикулярный шум, а сухой хрип в мелком суженном бронхе. Этот шум не постоянный, но может выслушиваться в течение нескольких часов кряду на небольшом участке грудной клетки, где-либо у границы относительной тупости сердца или сосудистого пучка.
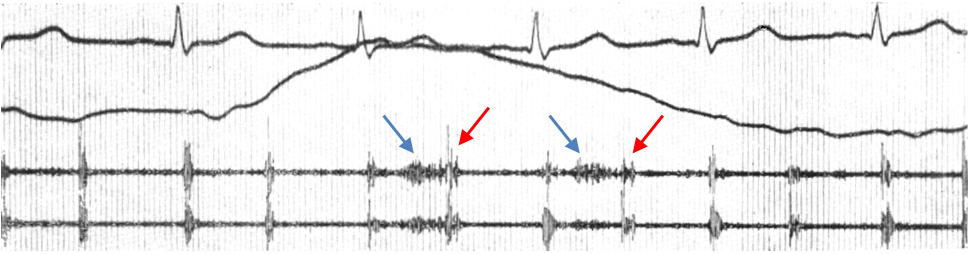
Рис. 9. Кардиопульмональный шум.
Сверху вниз: ЭКГ II отведение. Пневмограмма. ФКГ В1 и С2. В двух первых и двух последних сердечных циклах (выдох) тоны без особенностей, шума нет. На вдохе II тон расщеплен с интервалом 0,4 с (красные стрелки), появляется высокочастотный мезосистолический шум (синие стрелки), приближающийся к веретенообразному.
Лекция. Лабораторные и инструментальные методы исследования в кардиологии
Исследование крови у многих больных с заболеваниями сердечно-сосудистой системы позволяет получить важную информацию о характере и активности патологического процесса. Наиболее часто анализ крови используется для оценки следующих патологических состояний:
1. острый инфаркт миокарда;
2. атеросклероз и дислипопротеидемии;
3. активность воспаления (бактериальный эндокардит, миокардит, перикардит);
4. активность ревматической лихорадки (в том числе у больных с приобретенными пороками сердца);
5. нарушения свертываемости крови и тромбоцитарно-сосудистого гемостаза;
6. ДВС-синдром;
7. нарушения углеводного обмена, пуринового обмена;
8. Диагностика СЗСТ и т.д.
В данном разделе мы рассмотрим диагностические возможности клинического и биохимического анализов крови при остром инфаркте миокарда и атеросклерозе.
Лабораторная диагностика острого инфаркта миокарда
Лабораторное подтверждение острого инфаркта миокарда (ИМ) основано на выявлении:
1) неспецифических показателей тканевого некроза и воспалительной реакции миокарда и 2) гиперферментемии.
Неспецифическая реакция организма на возникновение острого ИМ связана прежде всего с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь и местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне. Основными лабораторными признаками, отражающими эти процессы, являются:
1. лейкоцитоз, не превышающий обычно 12–15 х 109/л;
2. анэозинофилия;
3. небольшой палочкоядерный сдвиг формулы крови влево;
4. увеличение СОЭ.
Запомните
1) При остром ИМ повышение температуры тела и лейкоцитоз выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели. 2) СОЭ увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений ИМ. 3) Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных острым ИМ свидетельствует о возможном развитии осложнений (пневмония, плеврит, перикардит, тромбоэмболия мелких ветвей легочной артерии и др.).
Следует подчеркнуть, что выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Необходимо также помнить, что правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Гиперферментемия при остром инфаркте миокарда
Гиперферментемия входит в классическую триаду признаков острого инфаркта миокарда: 1) болевой синдром; 2) типичные изменения ЭКГ; 3) гиперферментемия. Основной причиной повышения активности (и содержания) ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови:
1. креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК);
2. лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
3. аспартатаминотранферазы (АсАТ).
Динамика активности этих ферментов при остром ИМпредставлена в табл. 3.17 и на рис. 3.316.
Таблица 3.17
Изменение активности некоторых ферментов при остром инфаркте миокарда (по И. С. Балаховскому в модификации)
Фермент |
Начало повышения активности, ч |
Пик увеличения активности, ч |
Возвращениек норме, сутки |
МВ-фракция КФК |
3–4 |
10–12 |
2 |
КФК |
6–12 |
24 |
3–4 |
ЛДГ |
8–10 |
48–72 |
8–14 |
ЛДГ1 |
8–10 |
24–84 |
10–12 |
АсАТ |
4–12 |
24–36 |
4–7 |
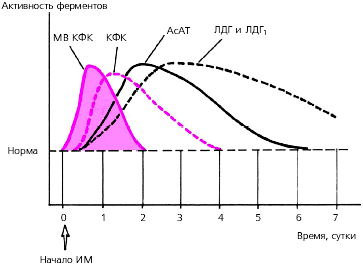
Рис. 3.316. Динамика активности ферментов сыворотки крови при остром инфаркте миокарда. Пунктиром обозначен нормальный уровень ферментов
Биомаркеры |
Время первичного увеличения |
Время достижения пиковой концентрации |
Длительность повышения |
Тропонин Т |
3 - 12 ч |
12 ч – 2 дня |
5 – 14 дней |
Тропонин I |
3 - 12 ч |
24 ч |
5 – 10 дней |
КФК-МВ (более 25% от общей КФК) |
3 - 12 ч |
24 ч |
2 – 3 дней |
Миоглобин |
1 - 4 ч |
6 – 7 ч |
24 ч |
Креатинфосфокиназа (КФК). Наиболее специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ-КФК). Ее активность начинает возрастать уже через 3–4 ч, достигает максимума через 10–12 ч и возвращается к исходным цифрам через 48 ч от начала ангинозного приступа. Активность общей КФК приИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 3.316).
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций:
1. при внутримышечных инъекциях;
2. при тяжелой физической нагрузке;
3. после любого хирургического вмешательства;
4. у больных мышечной дистрофией, полимиозитом, миопатией;
5. при повреждениях скелетных мышц, при травмах, судорожном синдроме, длительной иммобилизации;
6. при инсультах и других повреждениях ткани головного мозга;
7. при гипотиреозе;
8. при пароксизмальных тахиаритмиях;
9. при миокардите;
10. при тромбоэмболии легочной артерии;
11. после проведения коронароангиографии;
12. после электроимпульсной терапии (кардиоверсии) и т. д.
В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Тем не менее следует помнить, что любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. В литературе имеются также указания на возможность повышения уровня МВ-КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК. Следует, однако, иметь в виду, что в ряде случаев при обширных ИМ вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активностиМВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой «концентрация-время» остается одинаковой (рис. 3.317, а, б).
Эти данные послужили основанием для разработки методики неинвазивного определения массы некроза (в граммах) как функции площади под кривой изменения концентрацииМВ-КФК во времени.
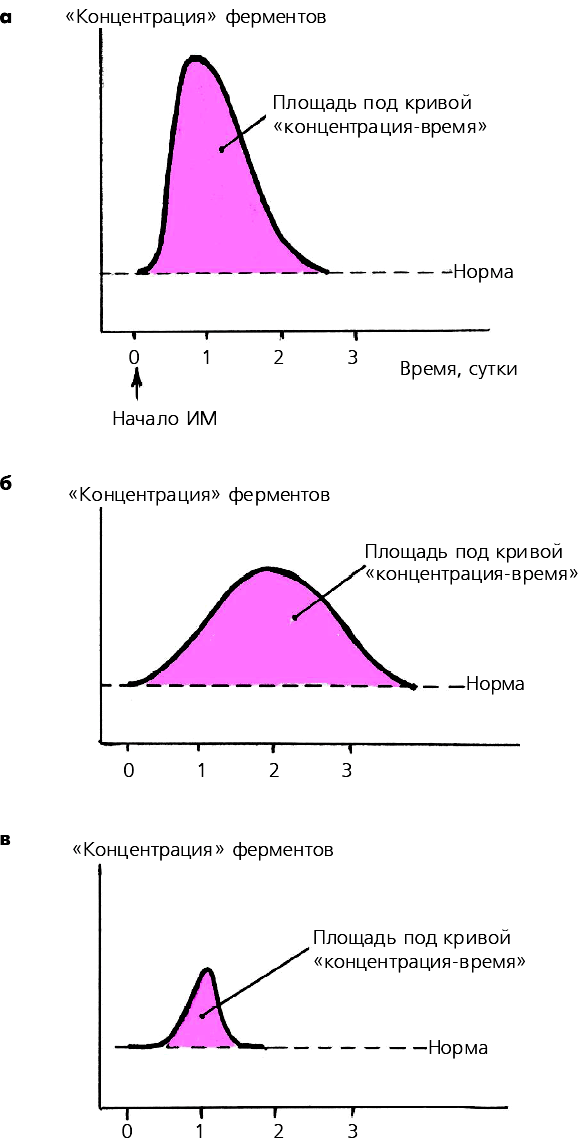
Рис. 3.317. Динамика активности МВ-фракции КФК при обширном трансмуральном (а,б) и интрамуральном (в) инфарктах миокарда.
В двух первых случаях площадь под кривой «концентрация–время» одинакова, хотя пиковые значения активности МВ-КФК отличаются, что связано с различной скоростью вымывания фермента. При интрамуральном инфаркте миокарда площадь под кривой и максимальная ее амплитуда значительно меньше
Запомните
Площадь под кривой «концентрация-время» МВ-КФК отражаетразмеры ИМ, а абсолютные значения активности фермента и время достижения максимума кривой — не только обширность поражения сердечной мышцы, но и скорость вымывания фермента из некротизированного участка сердечной мышцы.
Лактатдегидрогеназа (ЛДГ). Активность этого фермента при остром ИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной. Пик активности наступает обычно на 2–3 сутки от начала инфаркта, а возвращение к исходному уровню — только к 8–14 суткам.
Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, тромбоэмболии легочной артерии, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
В этом отношении изофермент ЛДГ1 более специфичен для поражений сердца, в частности, для острого ИМ, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотранфераза (АсАТ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта). Через 4–7 суток концентрация АсАТ возвращается к исходному уровню.
Изменение активности АсАТ также неспецифично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца —АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33.
Учитывая специфические особенности вымывания различных ферментов из очага некроза и длительность их присутствия в сыворотке крови, необходимо помнить о нескольких принципах ферментативной диагностики острогоИМ.
Запомните
1. Исследование уровня активности КФК и МВ-КФК целесообразно только в течение 1–2 суток, а АсАТ — 4–7 суток от предположительного начала заболевания. 2. Если с момента ангинозного приступа прошло более двух суток, для лабораторного подтверждения ИМ необходимо исследовать в динамике уровень активности ЛДГ, ЛДГ1 и АсАТ вместе с АлАТ и расчетом коэффициента Ритиса. 3. Повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АсАТ не является строго специфичным для острого ИМ, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью. 4. Отсутствие гиперферментемии не исключает развития ИМ.
Окончательная трактовка результатов исследования ферментов в сыворотке крови при остром ИМ возможна только в комплексе с оценкой клинической картины заболевания, изменений ЭКГ и данных других лабораторных и инструментальных методов исследования.
Исследование липидного обмена
Нарушения липидного обмена (гиперлипопротеидемии) являются важнейшим фактором риска атеросклероза и патогенетически связанных с ним заболеваний сердечно-сосудистой системы (инфаркта миокарда, хронических формИБС, инсульта, облитерирующего атеросклероза артерий нижних конечностей и др.). Поэтому исчерпывающая характеристика нарушений липидного обмена является обязательным условием эффективной профилактики этих заболеваний, определяющих, по сути, прогноз жизни, трудоспособность и физическую активность в быту большинства людей преклонного возраста во всех экономически развитых странах.
Напомним, что в плазме (сыворотке) крови присутствуют три основных класса липидов: 1) холестерин (ХС) и его эфиры, 2) триглицериды (ТГ) и 3) фосфолипиды (ФЛ). Наибольшее значение в атерогенезе имеют холестерин и триглицериды. Основной транспортной формой липидов являются, как известно, липопротеиды (ЛП), в которых ХС, ТГ и ФЛ связаны с белками-апопротеинами (подробнее — см. главу 1).
Для характеристики нарушений липидного обмена используют определение: 1) общего количества ХС и ТГ в плазме (сыворотке) крови; 2) содержание отдельных классов липопротеидов (ЛПНП, ЛПОНП и ЛПВП); 3) расчет коэффициента атерогенности. В большинстве случаев этих данных бывает достаточно, чтобы оценить характер и выраженность нарушений липидного обмена, а также степени атерогенности этих нарушений. В последние годы дополнительно к этим исследованиям рекомендуют определять также содержание белков-апопротеинов, входящих в состав ЛП (апо-А, апо-В и др.) и отличающихся различным влиянием на атерогенез, хотя эти методы пока не нашли широкого распространения в клинической практике.
Общее содержание ХС и ТГ в плазме (сыворотке) крови
При различных дислипидемиях может повышаться содержание ХС (гиперхолестеринемия) или ТГ(гипертриглицеридемия). Часто встречается также так называемая комбинированная гиперлипидемия, при которой имеет место повышение концентрации как ХС, так и ТГ.
Одной из наиболее сложных проблем диагностики гиперлипидемий является вопрос о том, какой уровень ХС иТГ считать «нормальным». Как известно, содержание обоих липидов в плазме (сыворотке) крови здоровых людей колеблется в широких пределах и зависит прежде всего от возраста и пола (см. главу 1): с возрастом у здоровых людей уровень ХС и ТГ постепенно возрастает; у мужчин он выше, чем у женщин. Усредненной и весьма условной верхней границей считают для ХС-5,17 ммоль/л (200 мг/дл) и дляТГ-1,7 ммоль/л (150 мг/дл).
В то же время сопоставление этих границ с данными, полученными при обследовании больших популяций здоровых людей, показывает, что у многих из них уровень холестерина существенно превышает 5,17 ммоль/л, а триглицеридов — 1,7 ммоль/л. Дело в том, что атерогенное действие ХС и ТГ существенно возрастает при наличии у обследуемых таких факторов риска атеросклероза как отягощенная наследственность (ИМ, инсульт, внезапная смерть у родственников в возрасте до 55 лет), курение, артериальная гипертензия, сахарный диабет, ожирение (масса тела, на 30% превышающая идеальную массу тела, и др.). У этих лиц «нормативы» ХС и ТГ должны быть значительно снижены.
Многочисленные клинические наблюдения позволили рекомендовать наиболее приемлемые в настоящее время уровни ХС и ТГ, представленные в табл. 3.18. Они включают деление на желательный, погранично высокий и повышенный уровень ХС и ТГ.
Таблица 3.18
Градации уровней холестерина и триглицеридов в плазме (сыворотке) крови
Липиды |
Единицы измерения |
Желатель- ный уровень |
Пограничновысокий уровень |
Повышен- ный уровень |
ХС |
ммоль/л |
< 5,17 |
5,17–6,18 |
6,21 |
|
мг/дл |
< 200 |
200–239 |
240 |
ТГ |
ммоль/л |
< 1,70 |
1,71–2,29 |
> 2,30 |
|
мг/дл |
< 130 |
130–200 |
> 200 |
Формально гиперхолестеринемия диагностируется при содержании ХС в плазме (сыворотке) крови, превышающем 6,2 ммоль/л (240 мг/дл), а гипертриглицеридемия — при концентрации ТГ больше 2,3 ммоль/л (200 мг/дл). Однако следует иметь в виду, что сочетание погранично высокого уровня ХС (5,2–6,2 ммоль/л) и ТГ (1,7–2,3 ммоль/л), а иногда даже более низких их концентраций, с другими факторами риска может иметь такое же значение для формирования и прогрессирования атеросклероза, как и более высокий уровень этих липидов, но при отсутствии артериальной гипертензии, сахарного диабета, ожирения, отягощенной наследственности и т. п.
Как было показано выше (см. главу 1), гиперхолестеринемия, гипертриглицеридемия и комбинированная гиперлипидемия встречаются не только при атеросклерозе, но и при многих заболеваниях печени, желчевыводящей системы, почек, эндокринной системы и т. д. Так, повышение уровня ХС и ТГнередко наблюдается при сахарном диабете, нефротическом синдроме, микседеме, обтурационной желтухе, холестатическом синдроме, беременности и других состояниях.
Липопротеиды плазмы (сыворотки) крови
Соотношение отдельных классов липопротеидов (ЛП) служит основанием для выделения 5 типов гиперлипопротеидемий по Фредриксону (подробнее см. главу 1). Наибольшее значение для атерогенеза имеют II, III и IV типы, для которых характерно повышение содержания ЛПНП и ЛПОНП, наиболее богатых, соответственно, ХС иТГ. Главными белками, входящими в состав этих ЛП, являются апо-В. При увеличении ЛПНП и ЛПОНП имеется высокий риск развития атеросклероза и патогенетически связанных с ним заболеваний (ИБС, ИМ, инсульт, облитерирующий атеросклероз артерий нижних конечностей и др.).
Не меньшее значение имеет содержание в плазме ЛПвысокой плотности (ЛПВП), обладающих антиатерогенным действием. Их содержание обратно пропорционально скорости развития раннего атеросклероза. Чем ниже концентрация в плазме ЛПВП, тем выше риск развития атеросклероза. Антиатерогенное действие ЛПВП связано, по-видимому, с их активным участием в метаболизме ХС и ТГ, а также со стимуляцией простациклина и, соответственно, с угнетением агрегации тромбоцитов и т. д.
Факторами, способствующими снижению уровня ЛПВП, являются (А. Н. Климов и Н. Г. Никульчева): 1) принадлежность к мужскому полу; 2) ожирение; 3) гипертриглицеридемия; 4) высокое потребление углеводов; 5) диабет у взрослых; 6) курение.
Высокий уровень антиатерогенных ЛПВП связывают с: 1) принадлежностью к женскому полу; 2) высоким уровнем эстрогенов; 3) высокой физической активностью; 4) снижением массы тела; 5) умеренным потреблением алкоголя.
Запомните
Решающее значение для возникновения и прогрессирования атеросклероза имеет соотношение липопротеидов различных классов: ЛПНП и ЛПОНП обладают отчетливым атерогенным, а ЛПВП–антиатерогенным действием. Наиболее высокий риск развития атеросклероза наблюдается у лиц с высоким содержанием ЛПНП и ЛПОНП и низким — ЛПВП.
Коэффициент атерогенности. Для ориентировочной количественной оценки степени риска атеросклероза А. Н. Климовым в 1977 г. был предложен так называемый холестериновый коэффициент атерогенности (КХС), представляющий собой отношение ХС атерогенных и ХСантиатерогенных ЛП:
КХС = ХСЛПНП + ХСЛПОНП / ХСЛПВП ,
Поскольку суммарное количество ХС атерогенных липопротеидов (ЛПНП и ЛПОНП) можно представить как разницу между общим ХС (ХС общий) и ХС ЛПВП, коэффициент атерогенности можно рассчитывать на основании определения только двух показателей — общегоХС и ХС ЛПВП:
КХС = ХСобщ - ХСЛПВП / ХСЛПВП .
Запомните
В норме у мужчин в возрасте 40–60 лет без клинических и других проявлений атеросклероза КХС не превышает 3,0–3,5. Вероятность развития атеросклероза относительно невелика при КХС менее 3,0. Коэффициент атерогенности в пределах 3,0–4,0 ассоциируется с умеренным, а больше 4,0 — с высоким риском атеросклероза.
Лабораторная диагностика инфекционного эндокардита
ОАК
Общий анализ крови при ИЭ обычно выявляет умеренную нормохромную анемию; увеличение СОЭ, иногда до 70-80 мм/ч; характерен лейкоцитоз со сдвигом лейкоцитарной формулы влево.
Биохимический анализ крови
увеличение концентрации сиаловых кислот и диспротеинемия с увеличением уровня гамма-глобулинов.
уваличение ЦИК и гипокомплементемия.
повышение С-реактивного белка.
Ревматоидный фактор обнаруживают у 35-50% больных подострым инфекционным эндокардитом.
Моча
В анализах мочи обнаруживают микрогематурию и протеинурию.
При развитии гломерулонефрита возникает выраженная протеинурия и гематурия.
Гемокультура
Бактериемия при подостром инфекционном эндокардите является постоянной. Количество бактерий в венозной крови составляет от 1 до 200 в 1 мл при подострой форме заболевания. Для выявления бактериемии рекомендуют трижды производить забор венозной крови в объёме 16-20 мл с интервалом 1 ч между первой и последней венепункцией. При выявлении возбудителя необходимо определить его чувствительность к антибиотикам.
Выраженность изменений лабораторных анализов при ревматизме, в первую очередь, зависит от активности процесса. В неактивную фазу заболевания лабораторные данные существенно не меняются, в этот период может быть некоторое увеличение СОЭ и антистрептококковых антител (АСЛ-О, АСГ, АСК). Изменения лабораторных показателей в активную фазу заболевания пропорциональны степени (1, 2, 3) активности ревматизма.
Общий анализ крови — при остром течении и выраженности процесса отмечается лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы влево, моноцитоз,СОЭ до 20 - 30 мм/ч и выше.
В общем анализе мочи при ревматизме существенных изменений не отмечается, возможна небольшая протеинурия и гематурия (микро).
В биохимическом анализе крови повышение уровня фибриногена, серомукоида, сиаловых кислот, церулоплазмина. Нарастает содержание альфа- и гамма-глобулинов, активность некоторых ферментов (АЛТ, лактатдегидрогеназы ЛДГ, малатдегидрогеназы, креатинкиназы и др.). Появляется С-реактивный белок, возрастает НСТ-тест. Активность миелопероксидазы в нейтрофилах снижается.
Иммунологические анализы при ревматизме показывают повышение титра антистрептогиалуронидазы, антистрептолидазы (АСЛ — О), антистрептокиназы, содержание иммуноглобулинов (в основном иммуноглобулина М ииммуноглобулина G). Регистрируется повышение реакции бласттрансформациилимфоцитов, снижение числа Т-лимфоцитов, появление циркулирующих иммунных комплексов и С-реактивного белка.
Рекомендуется провести бактериологический посев из зева для определения чувствительности выделенной флоры к антибиотикам.
Диагностика других патологических состояний
нарушения свертываемости крови и тромбоцитарно-сосудистого гемостаза, определнеие Д-Димера (атеротромбозы, тромбофлебиты);
ДВС-синдром (изменения в системекоагуляционного и тромбоцитарного гемостаза);
нарушения углеводного обмена (СД);
нарушения пуринового обмена (подагра);
маркеры аутоиммунных заболеваний (СЗСТ)
Инструментальная диагностика вкардиологии
I – неинвазивные
ЭКГ
Суточное мониторирование ЭКГ по Холтеру
ЭКГ при нагрузочных пробах (ВЭМ, тредмил-тест, ЧПЭС)
ЭКГ при фармакологических пробах (проба с добутамином, проба с дипиридамолом)
Суточное мониторирование АД
ЭХО-КГ (в покое, стресс-ЭХО-КГ)
Радиоизотопное исследование перыузии миокарда
Мультиспиральная КТ сердца и коронарных артерий
Электронно-лучевая томография сердца
I I – инвазивные методы исследования
Коронарная ангиография
Внутрисосудистое УЗИ коронарных артерий
Электрокардиограмма (ЭКГ) - это графическое представление разности потенциалов, возникающей во время работы сердца на поверхности тела, регистрируемой аппаратом под названием электрокардиограф в процессе электрокардиографии. Является одним из основных методов диагностики сердечно-сосудистых заболеваний.
При помощи ЭКГ возможно исследование функций сердца: автоматизма, возбудимости и проводимости.
Обычно на ЭКГ можно выделить 5 зубцов: P, Q, R, S, T. Иногда можно увидеть малозаметную волну U. Зубец P отображает работу предсердий, комплекс QRS - систолу желудочков, а сегмент ST и зубец T - процесс реполяризации миокарда.
Применение ЭКГ
Определение частоты и регулярности сердечных сокращений (нарушение автоматизма –нарушения ритма, нарушение возбудимости - экстрасистолии)
Показывает острое или хроническое повреждение миокарда
Диагностика коронарной недостаточности - метод скрининга при ИБС (СН, ОИМ), в том числе и при нагрузочных пробах
Может быть использована для выявления нарушений обмена калия, кальция, магния и других электролитов
Выявление нарушений внутрисердечной проводимости (блокады)
Определение гипертрофии предсердий и желудочков
Определение нарушений метаболизма в сердечной мышце (нарушение в конечной части желудочкового комплекса – зубца Т)
Может дать информацию о внесердечных заболеваниях, таких как ТЭЛА
Особое значение имеет ЭКГ в диагностики коронарной недостаточности СН, ОИМ (зубец Q, сегмент ST, зубец Т) – можно определить стадию ОИМ, локализацию.
Актуальной проблемой кардиологии является ранняя диагностика коронарогенных поражений миокарда, что связано с ростом внезапной смертности от сердечно-сосудистых заболеваний, особенно у людей молодого возраста. Оценка адекватности коронарного кровотока неинвазивными методами играет важную роль в решении этой проблемы. Простота, доступность, повторяемость позволяет их использовать для выявления скрытой ишемической болезни сердца (ИБС), определения физических возможностей организма для работы в условиях с большими физическими и психоэмоциональными нагрузками, а также как важный критерий трудоспособности у лиц, перенесших обострение ИБС. ЭКГ используются при проведении нагрузочных проб с целью выявления ИБС, они позволяют диагностировать скрытые формы нарушения сердечного ритма, нарушения адаптационно-метаболического генеза, проявляющиеся в виде признаков изменения фазы реполяризации, различной степени транзиторных блокад, нарушений сердечного ритма. Используемые в настоящее время все нагрузочные пробы можно условно разделить на две группы: 1-я группа — ЭКГ-тесты, провоцирующие ишемию, велоэргометрия, тредмил-тест, кистевая изометрическая проба, информационная, нагрузочная проба методом чреспищеводной электрокардиостимуляции, проба с изопротеренолом, дипиридамолом, эргометрином, добутамином; 2-я группа — ЭКГ-пробы, выявляющие дистрофию миокарда, нейрогенного, эндокринного и обменного генезов, улучшающие функцию сердца (проба с предварительной дачей блокаторов, калия хлорида, нитроглицерина, проба с гипервентиляцией и ортостатическая проба). Пробы с физической нагрузкой имеют как свои положительные, так и отрицательные стороны.
К положительным можно отнести: доступность, физиологичность выполнения пробы, возможность повторить пробу, точность дозированной мышечной работы, возможность регистрировать ЭКГ непосредственно в условиях выполнения нагрузок,
к отрицательным — не все больные способны выполнять дозированную физическую нагрузку (детренированность, наличие сопутствующих заболеваний, выраженная дыхательная недостаточность, недостаточность кровообращения, артериальная гипертензия, ортопедические дефекты и т.д.).
Пробы с дозированной физической нагрузкой.
Пробы с дозированной физической нагрузкой проводят, используя ряд методик, которые неравнозначны как в отношении результатов тестирования, так и по переносимости больными. 1. Степ-тест (проба Мастера) — методика, стандартизированная по физической нагрузке, с использованием двух ступенек высотой 22,5 см. 2. Велоэргометрия — метод с постоянно возрастающей ступенчатой функциональной нагрузкой, которая задается больному, находящемуся в сидячем или лежачем положении на специально оборудованном велосипеде. 3. Тредмил — бегущая дорожка с меняющимся углом подъема. 4. Телеэлектрокардиография — запись ЭКГ на расстоянии с передатчика. В США повсеместное распространение получила проба на тредмиле.
В России, как и в других европейских странах, большое распространение в лечебных учреждениях получила проба на велоэргометре.
Показания к проведению пробы с физической нагрузкой 1. Выявление скрытой коронарной недостаточности.
2. Выявление скрытых нарушений сердечного ритма и проводимости. 3. Атипичный болевой синдром, локализующийся в области грудной клетки. 4. Неспецифические изменения ЭКГ, записанные в покое при отсутствии болевого синдрома. 5. Атерогенные нарушения липидного состава крови при отсутствии клинических признаков коронарной недостаточности. 6. Определение толерантности к физической нагрузке у людей с ИБС и без нее. 7. Проведение контроля за эффективностью лечебных и реабилитационных мероприятий. 8. Для систематических тренировок с лечебной целью, оценки функционального состояния сердца у лиц, занимающихся физкультурой и спортом.
Противопоказания для проведения проб с физической нагрузкой Абсолютные: 1) острый инфаркт миокарда (менее трех недель); 2) быстро прогрессирующая или нестабильная стенокардия; 3) предынсультное состояние; 4) острый тромбофлебит; 5) недостаточность кровообращения IIБ—III стадии; 6) выраженная дыхательная недостаточность; 7) выраженный стеноз и недостаточность клапана аорты. Физиологическая реакция на нагрузку 1. Увеличение ЧСС (в меньшей степени выражено у спортсменов). 2. Увеличение систолического АД (у молодых людей систолическое давление обычно не превышает 200 мм рт. ст., а у пожилых — 230 мм рт. ст.). Одновременно имеет место снижение или небольшое увеличение диастолического АД. У спортсменов иногда имеются признаки более быстрого увеличения систолического и более выраженного снижения диастолического давления. 3. Физиологические изменения ЭКГ: с повышением мощности нагрузки наблюдается пропорциональное увеличение ЧСС, укорочение интервалов P—Q и Q—Т, появление заостренных зубцов P и депрессия (снижение) сегмента P—R при значительной ЧСС, небольшое снижение вольтажа зубца R, изменение сегмента S—T — слегка нарастающая депрессия сегмента S—T (1—2 мм и длительностью менее 0,06 с) с депрессией точки J. Увеличение или снижение амплитуды зубца Т, возникновение отрицательных зубцов Т — признаки неспецифические. Наибольшая депрессия сегмента S—T может наблюдаться при изменениях положения тела и у здоровых лиц после нагрузки. Генез этих изменений и их значение не ясны. 4. Появление одышки, утомляемости, потливости, ощущения жара и т.д. Заключения о нарушениях сердечного ритма, проводимости, возбудимости и так далее базируются на положениях, используемых при оценке ЭКГ покоя.
Для диагностики коронарной недостаточности при оценке пробы с физической нагрузкой пользуются следующими основными формами заключения: 1) проба положительная; 2) проба отрицательная; 3) проба сомнительная; 4) проба незавершенная. Критерии положительной пробы 1. Развитие типичного приступа стенокардии. 2. Появление тяжелой одышки или удушья. 3. Снижение артериального давления на 25—30 % от исходного уровня. 4. Снижение сегмента S—T по “ишемическому типу” (на 1 мм и более). 5. Подъем сегмента S—T (более чем на 1 мм). Различные изменения сегмента ST при физической нагрузке представлены на рисунках 4 и 5. 6. Инверсия зубца U, связанная с ишемией папиллярных мышц. 7. Сложные нарушения сердечного ритма и проводимости (пароксизмы наджелудочковой или желудочковой тахикардии, предсердная экстрасистолия у больных после аортокоронарного шунтирования, пробежки политопной и полиморфной желудочковой экстрасистолии, ранние экстрасистолы, развитие атриовентрикулярных или внутрижелудочковых нарушений проводимости). Особую диагностическую ценность имеет сочетание приступа стенокардии с соответствующими изменениями на ЭКГ.
Критерии отрицательной пробы Проба считается отрицательной в том случае, если у обследуемого достигается субмаксимальная частота сердечных сокращений без подтвержденных клинически и электрокардиографически признаков ишемии миокарда. Отрицательные результаты пробы не исключают наличия ИБС, но свидетельствуют об отсутствии выраженного поражения коронарных артерий и хорошем коронарном резерве.
Холтеровское мониторирование ЭКГ
В 1954 г. появилась первая публикация о клиническом применении радиоэлектрокардиографии, осуществленная Холлтером с соавторами. Исходно длительная запись ЭКГ была предпринята для регистрации миокардиальной ишемии по изменениям сегмента ST—T. В дальнейшем мониторирование использовалось для выявления аритмий. Лишь спустя десятилетие вновь появился интерес к анализу конечной части желудочкового комплекса для диагностики ишемии миокарда. Практическое использование холлтеровского мониторирования с этой цепью началось с 1973 г. исследованиями Стерна и Тзивони.
Алгоритмический анализ включает в себя диагностику пауз, характер которых в большинстве случаев не уточняется. Диагноз ставится в диалоговом режиме работы врача с компьютером. Анализ сегмента S—T связан с большими техническими трудностями, и почти всегда врачу не следует полагаться на автоматическую интерпретацию изменений сегмента S—T.
Существует два основных подхода в анализе сдвигов S—T: 1) определение смещения точки j относительно изоуровня; 2) определение наклона сегмента S—T. Перед началом анализа мониторной записи ЭКГ врач вводит в компьютер данные из дневника пациента. Наличие дневника пациента — непременное условие расшифровки монитора. Продолжительность записи. Длительность холлтеровского мониторирования ЭКГ определяется задачами исследования. Известно, что наибольшее число желудочковых экстрасистол, в том числе парных, R на Т выявляется в первые 6—12 ч наблюдения. Следовательно, при скрининговых обследованиях для выявления жизнеугрожающих экстрасистол достаточно мониторирования в течение 12 ч. Напротив, такие нарушения ритма, как желудочковые тахикардии, выявляются при более длительном наблюдении и находятся в линейной зависимости от продолжительности мониторирования. Обычно хватает суточного мониторирования ЭКГ для выявления тахиаритмий. При наличии же синкопальных или полуобморочных состояний для выявления их причин необходимо мониторирование ЭКГ более продолжительное время, более 24 ч. Имеются данные о том, что при увеличении мониторирования до 3 суток процент выявления атриовентрикулярных и синоатриальных блокад увеличивается в 3 раза. Для исследования динамики сегмента ST также достаточно суточного мониторирования ЭКГ. При анализе ЭКГ особое внимание уделяется часам, когда возможно развитие “немой” ишемии миокарда. Показания к проведению холтеровского мониторирования. I. Диагностика ранее не выявленных аритмий. 1. Жалобы на обморочные, полуобморочные состояния, головокружения неясной причины. 2. Сердцебиение, перебои в работе сердца. 3. Установленный синдром длительного Q—T. 4. Сердцебиение у больных с установленным диагнозом предвозбуждения.
II. Диагностика ишемии миокарда. 1. Неясные боли в груди, которые не позволяют исключить или подтвердить стенокардию. 2. Внезапная одышка, слабость неясного генеза. 3. Вариантная стенокардия. 4. Стенокардия покоя. 5. Стенокардия напряжения. 6. Диагностика “немой” ишемии при наличии положительной ВЭМ-пробы. III. Оценка эффективности лечения. 1. Оценка антиаритмического лечения. 2. Выбор лечения при мерцании предсердий при установке адренергического либо холинергического типов мерцания. 3. Оценка проаритмического действия препаратов с высоким риском его развития. 4. Оценка эффективности радиочастотной (или иной) облации проводящих путей у больных с синдромом предвозбуждения, желудочковыми тахикардиями и другими аритмиями. 5. Оценка антиангинальной терапии. 6. Оценка хирургического лечения коронарной недостаточности. 7. Оценка работы искусственного водителя ритма. IV. Профилактическое наблюдение за больными с возможными угрожающими аритмиями.
1. При заболеваниях с нарушенной сократительной функцией миокарда: 1) постинфарктные больные с дисфункцией левого желудочка; 2) больные ДКМЛ и ГКМП; 3) больные с пороками сердца.
2. С нарушениями водного электролитного баланса: 1) хроническая недостаточность кровообращения 2—3-й стадии; 2) терминальная почечная недостаточность.
3. С артериальной гипертензией: 1) артериальная гипертония с гипертрофией левого желудочка; 2) артериальная легочная гипертония с признаками легочно-сердечной недостаточности.
4. Перед оперативными вмешательствами: 1) на сердце; 2) на других органах. V. Проведение холлтеровского мониторирования с целью прогноза заболевания. Оценка вегетативной регуляции ритма сердца по данным временного и спектрального анализа вариабельности ритма сердца: 1) у больных диабетом с нейропатией; 2) у больных с ночными апноэ; 3) у больных с нарушенной функцией синусового узла для оценки хронотропной функции сердца; 4) у больных с цереброваскулярными кризами; 5) у больных с синдромом длинного Q—T.
Суточное мониторирование артериального давления (СМАД). СМАД – метод оценки суточного ритма артериального давления в естественных условиях. Она проводится с использованием носимых мониторов АД, которые прикреплены к человеку в течении суток. Цель исследования – повышение качества диагностики гипертензивных и гипотензивных состояний. |
Показания для проведения СМАД :
Диагностика артериальных гипертензий (АГ) 1. Пограничная АГ. 2. Выявление феномена "белого халата". 3. Подозрение на симптоматический характер АГ. 4. Обследование больных АГ в сочетании с ИБС, сердечной недостаточностью, гипертрофией миокарда левого желудочка, сосудистыми заболеваниями головного мозга, нарушениями углеводного и липидного обмена, синдромом апноэ во сне. 5. Обследование лиц молодого возраста, имеющих неблагоприятную наследственность по АГ.
Диагностика артериальных гипотензий 1. Обследование больных хронической конституциональной и ортостатической гипотонией. 2. Обследование больных с нарушениями постурального и динамического контроля АД. 3. Синкопальные состояния.
Контроль медикаментозного вмешательства 1. Отбор больных для проведения медикаментозного лечения. 2. Оценка эффективности и безопасности фармакотерапии. 3. Оценка резистентности к лекарственному лечению и подбор оптимальной схемы лечения у таких больных. 4. Изучение индивидуального суточного ритма АД при хронотерапевтическом режиме медикаментозного лечения.
Эхокардиография
Эхокардиография - диагностическая процедура, при которой используются возможности ультразвуковых волн проникать в ткани и отражаться от них, в результате чего после компьютерной обработки отраженных лучей формируется изображение сердца и его структурных элементов, его мышечной части (миокарда), клапанов сердца и характеристики циркуляции крови между камерами сердца.
Эхокардиография (ЭхоКГ) — это ультразвуковое исследование сердца (определение гипертрофии, сократительной способности), размеров полостей, клапанов, крупных сосудов, систолической и диастолический дисфункции желудочков.
При помощи ЭхоКГ можно определить размеры сердца, измерить толщину желудочков и предсердий, определить величину давления в сердечных камерах, оценить внутрисердечный кровоток, определить структуру крупных сосудов (аорты и легочного ствола), работу клапанного аппарата сердца и всего сердца + определить сократительную способность миокара (рассчитав ФВ). Также с помощью ЭхоКГ определяется наличие рубцовых изменений стенок сердца (следствие перенесенных в прошлом инфарктов миокарда).
ЭхоКГ не имеет противопоказаний, безболезненна, не требует специальной подготовки, не связана с облучением организма пациента рентгеновскими или другими видами радиоактивных излучений, не требует введения каких-либо медицинских инструментов в организм пациента (за исключением ЧПЭхоКГ – чрезпищеводной эхокардиографии), проводится в амбулаторных условиях.
В настоящее время в клинической практике широко используются следующие виды ЭхоКГ:
• Дуплексная ЭхоКГ (позволяет оценить размеры и сократимость предсердий и желудочков сердца, оценить анатомическую структуру их клапанов) • ДопплерЭхоКГ, в т.ч. цветное доплеровское картирование (позволяет оценить функцию клапанов сердца и диагностировать пороки сердца, в т.ч. врожденные, а также диагностировать повышение давления в легочных сосудах - легочную гипертензию ) • СтрессЭхоКГ (позволяет оценить состояние сократимости отдельных участков сердечной мышцы, что бывает очень важно у больных инфарктом миокарда) • Чрезпищеводная ЭхоКГ (является необходимой диагностической процедурой перед восстановлением ритма при мерцательной аритмии, т.к. обычная ЭхоКГ не позволяет визуализировать некоторые участки сердца).
ЭхоКГ назначается:
при ИБС, в том числе и при инфаркте миокарда
при подозрении на инфекционный эндокарлит
при артериальной гипертензии
пороках сердца (врожденных и приобретенных)
ОРЛ
ВСД (вегето-сосудистой дистонии)
нарушениях сердечной проводимости и сердечного ритма
при наличии шума и болей в сердце невыясненного генеза
при диагностике опухолей
при хронической сердечной недостаточности
кардиомиопатиях
миокардитах
перикардитах и др.
Рентгенография
Рентгенологическое исследование позволяет подтвердить наличие кардиомегалии и оценить состояние малого круга кровообращения. Достоверными рентгенологическими признаками кардиомегалии являются: увеличение поперечного размера сердечной тени до 15,5 см и более у мужчин и до 14,5 см и более у женщин; увеличение кардиоторакального индекса (отношения поперечного размера тени сердца к внутреннему поперечному размеру грудной клетки) до 50% и более. У большинства больных острым миокардитом рентгенологические признаки дилатации камер сердца на фоне эффективного лечения значительно уменьшаются или исчезают совсем.
У больных миокардитом с симптомами левожелудочковой недостаточности рентгенологически можно выявить признаки венозного застоя крови в легких: усиление легочного рисунка в верхних отделах легких за счет расширения мелких сосудов; расширение корней легких; горизонтальные линии Керли; выпот в плевральных синусах, чаще справа.
Сцинтиграфия – проводится с целью
1) определения наличия лейкоцитарной инфильтрации в миокарде и 2) выраженности перфузионных нарушений, в клинической практике используется томосцинтиграфия сердца с различными радиофармпрепаратами (РФП). Для визуализации воспаления используют радиофармпрепараты, избирательно накапливающиеся в зоне воспаления: цитрат галлия-67 (67 Ga ); аутолейкоциты, меченные технецием-99 или иидием-111-оксимом (111 In ) и антитела к миозину.
Использование однофотонной эмиссионной компьютерной томографии сердца (ОФЭКТ) позволяет получать качественные многомерные изображения миокарда с толщиной каждого томографического скана до 0,88 см. Таким образом, при анализе серии компьютерных срезов сердца можно определить наличие и протяженность лейкоцитарной инфильтрации в миокарде. Помимо определения воспаления в миокарде необходимо проведение повторной томосцинтиграфии с перфузиопными РФП.
Для выявления перфузионных нарушений используют такие РФП, как 99Тс-технетрил (или 99Тс-М1В1) и излучающие нуклиды таллия хлорида-201 (201Т1). Перфузионный РФП накапливается в иптактной ткани сердечной мышцы, оставляя участки ишемии, некроза и кардиосклероза в виде «дефектов накопления». В диагностике стенозирующего атеросклероза коронарных артерий необходимо проведение нагрузочных проб (велоэргометрия, тредмил, пробы с дофамином или дипиридамолом) и на высоте нагрузки, когда создаются условия несоответствия доставки кислорода в ткани и его повышенным потреблением, вводят перфузионный РФП, а затем проводят сцинтиграфию миокарда. Сцинтиграфия сердца используется для оценки микроциркуляторного русла, а нарушение микроциркуляции при сохранении магистрального кровотока по венечным артериям чаще всего связано с миокардитическим кардиосклерозом. Проведение радиоизотопной диагностики в комплексе из двух исследований (определение воспалительной инфильтрации, перфузии миокарда) позволяет оценить наличие воспалительной инфильтрации в миокарде, определить нарушение перфузии. Это связано с миокардитическим кардиосклерозом.
Магнитно-резонансная томография
Воспалительную инфильтрацию в миокарде можно выявить посредством магнитно-резонансной томографии (МРТ) с контрастированием парамагнитными контрастирующими препаратами. Метод МРТ позволяет визуализировать участки внеклеточной воды, характерных для отека миокарда. Для определения воспаления в миокарде сначала необходимо выполнить первичную МРТ сердца, затем внутривенно ввести парамагнитный контраст и через 10-30 минут провести повторное магнитно-резонансное исследование. Контраст избирательно накапливается в участках внеклеточной воды и изменяет резонансные свойства тканей. По серии изображений миокарда до и после контрастирования можно судить о локализации и протяженности воспалительной инфильтрации в миокарде.
Ультразвуковое исследование артерий
- дисфункция эндотелия
- утолщение комплекса интима-медиа
- атеросклеротическая бляшка
- лодыжечно-плечевой индекс давления
- дуплексное сканирование экстракраниального отдела брахиоцефальных артерий
Коронарография - рентгеноконтрастный метод исследования, который является наиболее точным и достоверным способом диагностики ИБС, позволяя точно определить характер, место и степень сужения коронарной артерии. Этот метод, является «золотым стандартом» в диагностике ИБС и позволяет решить вопрос о выборе и объеме проведения в дальнейшем таких лечебных процедур как баллонная ангиопластика и коронарное шунтирование.
Показания к проведению коронарографии
высокий риск осложнений по данным клинического и неинвазивного обследования, в том числе при бессимптомном течении ИБС
неэффективность медикаментозного лечения стенокардии
нестабильная стенокардия, не поддающаяся медикаментозному лечению, возникшая у больного с инфарктом миокарда в анамнезе, сопровождающаяся дисфункцией левого желудочка, артериальной гипотонией или отеком легких
постинфарктная стенокардия
невозможность определить риск осложнений с помощью неинвазивных методов
предстоящая операция на открытом сердце (например, протезирование клапанов, коррекция врожденных пороков сердца и т. д.) у больного старше 35 лет
Морфометрические методы
Все изменения, выявленные при лабораторном и иммунологическом обследовании, на ЭКГ и ЭхоКГ, не являются специфичными признаками, характерными для миокардита. Для установления окончательного диагноза необходимо подтверждать воспаление и его последствия морфометрическими методами.
К морфометрическим методам относятся:
- биопсия миокарда с последующим гистологическим изучением микропрепаратов; - томосцинтиграфия сердца с «воспалительными» и кардиотропными радиофармпрепаратами; - магнитно-резонансная томография сердца с контрастированием и ультразвуковая денситометрпя.
Эндомиокардиальная биопсия
Одним из методов диагностики воспалительного процесса в мышце сердца является эпдомиокарднальпая биопсия (ЭМБ). Показания к ЭМБ достаточно широки. Ее рекомендуют проводить при всех кардиомиопатиях для определения причин дилатации или гипертрофии сердца, а также при констриктивных и рестриктивных заболеваниях. Для морфологического подтверждения диагноза считается необходимым взять 3-7 биоптатов сердца. Основным морфологическим признаком воспаления является наличие клеточной инфильтрации, которая состоит из лимфоцитов, нейтрофилов, эозинофилов и гистиоцитов. Можно выявить отек межклеточного пространства, полнокровие сосудов микроциркуляторпого русла, набухание эндотелия, дистрофические изменения кардиомиоцитов и миокардитический кардиосклероз. Для морфологического подтверждения миокардита используют рекомендованные группой американских морфологов в 1986 г. - “далласские критерии”миокардита (таблица).
Диагноз миокардита |
Гистологические признаки |
Определенный миокардит |
Воспалительная инфильтрация миокарда с некрозом и/или дегенерацией прилегающих миоцитов, не характерных для ИБС |
Вероятный миокардит |
Воспалительные инфильтраты достаточно редки либо кардиомиоциты инфильтрированы лейкоцитами. Нет участков миоцитонекроза. Миокардит не может быть диагностирован в отсутствие воспаления |
Миокардит отсутствует |
Нормальный миокард или имеются патологические изменения ткани невоспалительной природы |
Лекция 8
Расспрос больного с заболеванием пищевода, желудка, кишечника
Экз. вопросы:
Основные жалобы пpи заболеваниях пищевода, их диагностическое значение.
Дисфагия: ее ваpианты, пpичины развития, детализация.
Пищеводная рвота: пpичины и механизм возникновения, детализация, диагностическое значение.
Основные жалобы пpи заболеваниях желудка, диагностическое значение.
Боль пpи заболеваниях желудка: причины и механизмы их возникновения, детализация, диагностическое значение.
Жалобы при заболеваниях пищевода:
- боль (одинофагия)
- дисфагия
- изжога
- отрыжка
- срыгивание
- пищеводная рвота
- кровотечение
Боль
По механизму возникновения выделяют следующие виды боли при заболеваниях пищевода: спастическая, дистензионная, перитонеальная и боль при непосредственном раздражении слизистой оболочки пищевода.
В норме в пищеводе слабощелочная среда. При забросе кислого содержимого желудка в пищевод происходит раздражение болевых рецепторов слизистой пищевода. Причинами являются заболевания, приводящие к органической или функциональной недостаточности нижнего пищеводного сфинктера.
Признаки: локализация – за грудиной, по характеру – жгучая, возникает или усиливается после работы внаклон, обильного приема пищи, употребления кофе, шоколада, газированных напитков. Купируется приемом антацидов.
Спастическая боль – это боль, возникающая в результате спазма гладкой мускулатуры пищевода.
Признаки: локализация – за грудиной, по характеру – острая, приступообразная (внезапно начинающаяся и нередко также внезапно заканчивающаяся), интенсивная боль, часто с иррадиацией, уменьшается или купируется после приема спазмолитиков или применения тепла. Причинами являются заболевания, сопровождающиеся нарушением нервной регуляции тонуса гладкой мускулатуры пищевода: неврозы, истерия, ботулизм.
Дистензионная боль – это боль, возникающая при растяжении стенок пищевода.
Признаки: локализация – за грудиной, по характеру – тупая, распирающая, малоинтенсивная, без иррадиации; не стихающая после приема спазмолитиков. Часто сопровождается пищеводной рвотой. Причинами являются заболевания, приводящие к органическому сужению пищевода.
Перитонеальные боли – это боли, возникающие в результате вовлечения в процесс париетальной брюшины. Пищевод покрыт брюшиной лишь в дистальном отделе. Перитонеальная боль возникает при раке пищевода с прорастанием наружной оболочки или при перфорации язвы пищевода с локализацией в нижней трети.
Признаки: возникает постепенно (при раке) или остро (при прободении язвы), постоянная, непрерывно усиливающаяся вплоть до нестерпимых болей.
Дисфагия (от dis - затруднение, нарушение и phagein - глотать) – это расстройство акта глотания, связанное с нарушением нормального прохождения пищи по пищеводу. При дисфагии больной жалуется на неприятные ощущения по ходу пищевода, впечатление остановки пищевого комка за грудиной, расстройство глотания (" комок в горле"), чувство саднения и жжения.
По уровню поражения дисфагия делится на ротоглоточную и пищеводную. Причинами ротоглоточной дисфагии являются процессы, приводящие к внутреннему сужению или сдавлению верхних отделов пищеварительного тракта снаружи: опухоли, стриктуры глотки, зоб, рак щитовидной железы, рак гортани, окологлоточный абсцесс; а также процессы, приводящие к нарушению акта глотания: при инсульте, миастении, бульбарном параличе.
Пищеводная дисфагия делится на органическую и функциональную.
Органическая дисфагия связана с органическим сужением пищевода, функциональная – со спазмом гладкой мускулатуры пищевода.
Причины органической дисфагии:
- заболевания пищевода с сужением его просвета: опухоли, рубцовые стриктуры, дивертикулы, язвы пищевода
- сдавление пищевода снаружи при опухоли средостения, дилатации левого предсердия (при митральном стенозе), аневризме аорты, грыже пищеводного отверстия диафрагмы.
Причины функциональной дисфагии – неврозы, истерии, ботулизм. При этом происходит нарушение нервной регуляции тонуса гладкой мускулатуры пищевода и возникает спазм циркулярных мышц, чаще в нижней трети пищевода – эзофагоспазм.
Отличия органической и функциональной дисфагии:
органическая дисфагия возникает у лиц среднего и пожилого возраста, функциональная – чаще у молодых
органическая дисфагия постоянна. Функциональная дисфагия – носит пароксизмальный, приступообразный характер. Провоцируется нервным перенапряжением, поспешной едой, приемом слишком холодной или слишком горячей пищи.
При органической дисфагии сначала затруднено прохождение твердой пищи, затем кашицеобразной и затем жидкой - прогрессирующий характер. Функциональная дисфагия – носит парадоксальный характер. При ней труднее проходит жидкая пища, твердая пища – легче.
Органическая дисфагия может сопровождаться пищеводной рвотой, кровотечением. Функциональная дисфагия такими симптомами не сопровождается, может сопровождаться спастической болью.
Изжога, причины и механизм возникновения.
Изжога – это ощущение жжения за грудиной и в подложечной области, возникающее в результате забрасывания содержимого желудка в пищевод и раздражения слизистой оболочки пищевода кислым желудочным содержимым.
Причинами изжоги являются:
Органическая недостаточность кардиального сфинктера: гастроэзофагеальная рефлюксная болезнь, грыжа пищеводного отверстия диафрагмы;
Функциональная недостаточность нижнего пищеводного сфинктера, возникающая вследствие повышения внутрижелудочного давления при употреблении большого количества пищи, стенозе выходного отдела желудка, метеоризме.
Отрыжка и срыгивание.
Отрыжка – непроизвольное выделение из желудка в полость рта газов.
Срыгивание – непроизвольное выделение в полость рта небольшого количества желудочного содержимого.
Механизм отрыжки и срыгивания связан с органической или функциональной недостаточностью нижнего пищеводного сфинктера. Отрыжка воздухом может наблюдаться у здоровых при переедании, употреблении газированных напитков, при физических упражнениях, если они выполняются сразу после еды. В этом случае происходит повышение давления в желудке и функциональная недостаточность НПС. Функциональная недостаточность НПС может быть признаком патологии при ГЭРБ, понижении моторной функции желудка у больных атрофическими гастритами, раком желудка.
Органическая недостаточность НПС возникает при несмыкании кардии, обусловленном органическими причинами и может встречаться при грыже пищеводного отверстия диафрагмы, язве пищевода, послеожоговых рубцах в нижней трети пищевода. Ахалазия кардии?
Пищеводная рвота
Причинами пищеводной рвоты являются заболевания, приводящие к органическому сужению пищевода. При этом выше места сужения происходит задержка пищевого комка, стенки пищевода растягиваются, и в результате раздражения рецепторов возникают антиперистальтические движения гладкой мускулатуры – возникает рвота.
Отличия пищеводной рвоты от желудочной:
Возникает обычно вскоре после приема пищи.
Пищеводной рвоте не предшествует тошнота (нет раздражения рвотного центра)
Совершается без участия мышц передней брюшной стенки
Рвотные массы представлены обычно остатками непереваренной малоизмененной пищи, не содержащей соляной кислоты и пепсина, с примесью слюны.
Пищеводное кровотечение
Причинами являются:
варикозное расширение вен пищевода (признак портальной гипертензии), чаще на почве цирроза печени,
рак пищевода,
язвы, эрозии пищевода,
синдром Меллори – Вейса – спонтанные продольные надрывы слизистой пищевода
Пищеводное кровотечение проявляется кровавой рвотой. Артериальное пищеводное кровотечение характеризуется рвотой с примесью неизмененной крови. Кровотечение из варикозных вен пищевода нередко бывает профузным и проявляется рвотой с кровью темно-вишневого цвета. При попадании крови из пищевода в желудок возможно появление рвоты «кофейной гущей» из-за образования солянокислого гематина.
Икота (постоянная или приступообразная) может быть следствием функциональных расстройств, поражения ветвей диафрагмального и блуждающего нервов, рака, эзофагита, язвы, грыжи пищеводного отверстия диафрагмы, ахалазии кардии.
Жалобы при заболеваниях желудка:
- боль
- тошнота
- рвота
- кровотечение
- изменение аппетита
Боль при заболеваниях желудка
Слизистая оболочка желудка не содержит болевых рецепторов. Боль при заболеваниях желудка появляется тогда, когда нарушается его моторная функция, т.е. возникают спазм гладкой мускулатуры (спастические боли) или растяжение его стенок (дистензионные боли). При вовлечении в патологический процесс париетального листка брюшины возникают перитонеальные боли.
Спастическая боль.
Причины: Основным стимулятором моторики желудка является соляная кислота, поэтому все заболевания с повышенной секрецией соляной кислоты могут быть причиной спастической боли. Это гастриты и язвы в области антрального и пилорического отдела желудка, дуодениты и язвы 12-перстной кишки. Как правило, патологические процессы такой локализации вызываются НР. Именно в антральном и пилорическом отделах желудка и 12-перстной кишке находится большое количество G-клеток – это клетки APUD-системы, вырабатывающие гастрин – местный гормон, регулирующий секрецию желудка.
Детализация спастической боли:
Локализация – подложечная область, по характеру – острая, приступообразная, возникает натощак (голодные боли), часто в ночное время; купируется приемом пищи (при язвенной болезни спастическая боль в ночное время купируется приемом молока), антацидов.
Дистензионная боль.
Причины:
Заболевания желудка со снижением или отсутствием выработки соляной кислоты:
- гастриты и язвы тела желудка
-атрофический гастрит
-рак желудка. При этом происходит замедление моторики желудка, замедление эвакуации содержимого желудка в 12-перстную кишку и перерастяжение его стенок.
стеноз выходного отдела желудка
- это осложнение язвенной болезни, когда в области привратника образуется рубцовое сужение после язвы и нарушение эвакуации пищи из желудка.
Детализация:
Локализация – подложечная область, по характеру – тупая, распирающая, ощущается как переполнение в желудке или чувство быстрого насыщения, провоцируется приемом пищи, особенно обильным, купируется самостоятельно через некоторое время по мере эвакуации содержимого желудка в 12-перстную кишку. При выраженном стенозе выходного отдела желудка больные самостоятельно вызывают рвоту, после чего боль купируется.
Перитонеальная боль.
Различают острую и хроническую перитонеальную боль. Острая перитонельная боль возникает при прободении язвы желудка, механизм боли связан с выходом кислого содержимого желудка в свободную брюшную полость. Такая боль возникает внезапно, по характеру – чрезвычайно острая, «кинжальная», нарастает по интенсивности.
Причины хронической перитонеальной боли – рак желудка с прорастанием брюшины и перивисцерит. Признаками этой боли являются отсутствие связи с приемом пищи, такая боль усиливается при движениях, перемене положения тела, при раке носит нарастающий во времени характер.
По времени возникновения различают следующие виды болей: ранняя, поздняя, голодная.
Ранние боли. При поражении кардиального отдела желудка боль обычно появляется через несколько минут после еды и локализуется непосредственно под мечевидным отростком, а при поражении тела желудка – через 30-40 мин после еды.
Поздние боли. Для патологических процессов, локализующихся в пилорической части желудка или в 12-перстной кишке, характерно появление болей через 1,5-2 ч после еды или так называемых «голодных» болей, которые появляются натощак и на время стихают после приема пищи.
При заболеваниях желудка у больного может измениться аппетит:
- снижение аппетита или отсутствие (анорексия)
- повышение
- извращение
Снижение аппетита – часто наблюдается у больных хроническим атрофическим гастритом со сниженной секреторной функцией.
Полное отсутствие аппетита (анорексия) в сочетании с отвращением к определенным продуктам встречается при раке желудка.
При язвенной болезни у пациентов отмечается цитофобия – страх перед приемом пищи из-за опасения последующего возникновения или усиления болей.
Усиление аппетита и потребность часто принимать пищу наблюдается при язве с локализацией в 12-перстной кишке. Мучительное ощущение голода с желанием немедленно лечь и принять пищу наблюдается при гипогликемическом синдроме, что часто наблюдается при постгастрорезекционных расстройствах.
Отрыжка.
Встречается при усилении в желудке процессов брожения при гастрите с секреторной недостаточностью. При забросе в желудок дуоденального содержимого с примесью желчи наблюдается горькая отрыжка. Отрыжка «тухлым» (гнилостная) появляется при образовании в желудке из белков в результате гниения веществ, содержащих сероводород и аммиак, и может указывать на длительную задержку содержимого в желудке у больных с декомпенсированным стенозом привратника.
Тошнота, причины и механизм возникновения.
Тошнота - это неприятное, тягостное ощущение, предшествующее рвоте или сопутствующее ей. Она обычно связана с пониженной функциональной активностью желудка и изменениями двигательной функции двенадцатиперстной и тонкой кишок. Тошнота возникает при повышении интрадуоденального давления, особенно свойственна - заболеваниям двенадцатиперстной кишки: дуодениту, гастродуодениту, язвенной болезни двенадцатиперстной кишки. Сопутствующая рвоте тошнота сопровождается изменениями активности вегетативной нервной системы (особенно парасимпатической): бледностью кожных покровов, повышенным потоотделением, обильным выделением слюны, слабостью, головокружением, шумом в ушах, часто гипотензией и брадикардией (вазовагальный синдром).
Желудочная рвота
Рвота (vomitus) - это рефлекторный акт выхода содержимого желудка через рот. Рвотный акт контролируется двумя функционально различными центрами в продолговатом мозге: рвотным центром и хеморецепторной триггерной зоной, которая сама по себе не способна опосредовать рвотный акт, но активация ее ведет к посылу эффективных импульсов к расположенному в продолговатом мозге рвотному центру, который в свою очередь вызывает рвотный акт. Оба эти центра расположены поблизости друг от друга и от других центров ствола мозга, регулирующих вазомоторные и вегетативные функции. Афферентные сигналы рвотный центр получает от кишечника и других органов, из вышерасположенных кортикальных центров, особенно из аппарата внутреннего уха, и из триггерной зоны. Важными эфферентными проводящими путями при рвоте являются диафрагмальные нервы (к диафрагме), спинномозговые нервы (к мышцам брюшной стенки) и висцеральные эфферентные нервы (к желудку и пищеводу). Рвота является заключительной стадией физиологического акта с вовлечением симпатической и вегетативной нервных систем, глотки, желудочно-кишечного тракта и скелетной мускулатуры грудной клетки и брюшной полости. Начало рвотных движений сопровождается слабостью, бледностью, потоотделением, брадикардией и снижением артериального давления. Происходит глубокий вдох, опускается надгортанник и поднимается гортань, что предохраняет дыхательные пути от попадания в них рвотных масс. В акте рвоты важную роль играет сокращение диафрагмы и мышц передней стенки живота, которое сопровождается антиперистальтическими сокращениями мышц желудка при закрытом привратнике.
Заболевания практически любой системы, особенно головного мозга, могут сопровождаться рвотой. В зависимости от механизма возникновения различаются несколько видов рвоты.
Центральная (мозговая, нервная) рвота. Заболевания нервной системы (отек головного мозга, обусловленный воспалением, гипоксемией, травмой, острой гидроцефалией, опухолями и т.д.), которые приводят к повышению внутричерепного давления, могут сопровождаться рвотой. Повреждения аппарата внутреннего уха и его центральных связей также часто сопровождаются тошнотой и рвотой. Мозговая рвота обычно развивается вне связи с едой, ей не предшествует тошнота, она не улучшает состояния больного, рвотные массы скудные, без запаха. В клинической картине преобладают головные боли, нарушения зрения и сознания; заболевания желудочно-кишечного тракта отсутствуют.
Гематотоксическая рвота возникает при печеночной и почечной недостаточности, болезнях обмена (галактоземия, ацетонемическая рвота, диабетическая прекома и др.), дигиталисной интоксикации, гипервитаминозе D, при острых отравлениях и др.
Висцеральная, или собственно рефлекторная - это пищеводная, желудочная, кишечная рвота.
Желудочная рвота возникает чаще на фоне заболеваний желудка. Рвоте при острых и хронических гастритах, гастродуоденитах, язвенной болезни, кишечных инфекциях и пищевых ток-сикоинфекдиях обычно предшествует тошнота, что отличает ее от рвоты, обусловленной раздражением рвотного центра. Она обычно связана с едой, приносит временное облегчение ребенку. Для рвотных масс, поступающих из желудка, характерен кислый запах. В рвотных массах обнаруживаются остатки непереваренной пищи, слизь, кровь (цвет кофейной гущи). Рвота, не приносящая облегчения, свойственна заболеваниям гепатобилиарной системы и поджелудочной железы. Примесь желчи в рвотных массах отмечается при всех упорных рвотах, независимо от причин, их вызывающих. Чаще способствует ее появлению дуодено-гастральный рефлюкс. Врожденные механические препятствия в двенадцатиперстной кишке (внутренний стеноз просвета кишки, атрезия двенадцатиперстной кишки, анулярная поджелудочная железа и др.), в отличие от пилоростеноза, ведут к появлению рвоты с примесью желчи на 4-5-й день после рождения. Рвотный акт, если он упорный и сильный, вследствие высокого давления может привести к разрыву пищевода (синдром Бурхаве) или линейным разрывам слизистой оболочки кардиального отдела желудка, что вызывает желудочное кровотечение (синдром Маллори-Вейсса).
У детей первых месяцев жизни может быть рвота "фонтаном". Это типичный признак пилоростеноза, являющийся показанием для более детального исследования (УЗИ желудка, рентгеноскопия с контрастным веществом). При стенозе привратника объем рвотных масс больше количества принятой пищи, с гнилостным запахом, в них не бывает примеси желчи. При мегадуоденуме, наоборот, в рвотных массах содержится примесь желчи. При пилороспазме отмечается многократная рвота небольшим количеством съеденной пищи.
Отдельные исследователи выделяют и стенотическую рвоту, наблюдающуюся у больных при стенозах привратника и двенадцатиперстной кишки, возникающую периодически 1 раз в 2—3 дня, иногда и каждый день. Рвотные массы имеют характерный неприятный бродильный или гнилостный запах, нередко содержат остатки пищи.
Рвота съеденной пищей нередко отмечается и при гастроптозе; рвота желчью — у больных с синдромом приводящей кишки (после резекции желудка) и с пептической язвой гастроэнтероанастомоза.
После рвоты, ассоциированной с поражением желудка, больной обычно чувствует значительное облегчение: уменьшение или исчезновение тошноты и болей. Этот факт в значительной степени объясняет стремление многих больных вызвать рвоту надавливанием на корень языка, мягкое небо или зев (целесообразно предварительно выпить большое количество жидкости). При проведении дифференциальной диагностики важное значение имеют выяснение и оценка таких факторов, как время появления рвоты, количество и состав рвотных масс, их реакция и окраска (наличие или отсутствие крови), а также оценка состояния больных после рвоты. У части больных тошнота как симптом, предшествующий рвоте, обычно возникает при желчнокаменной болезни, холецистите, панкреатите, а также при глистных инвазиях, перитоните, печеночной и почечной колике.
Кишечная рвота наблюдается при непроходимости кишечника (инвагинация, заворот, опухоли и т. д.). Рвота многократная, упорная, с каловым запахом (кишечного содержимого), сопровождается задержкой кала и газов. Ей предшествуют схваткообразные боли в животе.
Кровавая рвота (гематемезис) чаще всего возникает при повреждении крупного сосуда при гастродуоденальных эрозиях и язвах, эзофагите, опухоли желудка, из расширенных вен пищевода и желудка при портальной гипертензии, геморрагических диатезах, лейкозе, сепсисе, ожогах слизистой оболочки желудка, синдроме Маллори-Вейсса, гемангиоме и др.
Рвота с кровью наблюдается, когда объем кровопотери превышает 500 мл.
Цвет крови в рвотных массах варьирует в зависимости от концентрации соляной кислоты в желудке и ее перемешивания с кровью. Если рвота происходит не в момент кровотечения, а через небольшой промежуток времени, в течение которого кровь смешивается с желудочным содержимым (соляной кислотой), рвотные массы приобретают цвет кофейной гущи из-за солянокислого гематина. Обильная кровавая рвота после завтрака или в середине ночи, нередко с темно-красными сгустками, является симптомом варикозного расширения вен пищевода и кардиального отдела желудка. Кровь, попадающая в желудочно-кишечный тракт ниже двенадцатиперстной кишки, редко оказывается в желудке. Для однократного появления каловых масс черного цвета необходимо приблизительно 60 мл крови, острая кровопотеря, при которой выделяется большее количество крови, может вызвать мелену на протяжении 3 сут. Мелена – это черный, дегтеобразный стул, что обусловлено наличием сульфида железа, а также прото- и дейтеропорфиринов, образующихся из гемоглобина под воздействием ферментативных процессов в кишечнике. После нормализации окраски каловых масс тест на скрытую кровь может оставаться положительным в течение 1 нед и более.
В физиологическом отношении рвота является защитной реакцией пищеварительной системы, освобождает желудок от недоброкачественной пищи или токсических веществ. Вместе с тем длительная неукротимая рвота ведет к потере организмом воды и электролитов, в результате чего развиваются обезвоживание и хлорпеническая кома с явлениями алкалоза, а в хронических случаях - истощение организма.
При желудочном кровотечении в результате взаимодействия гемоглобина с соляной кислотой и образования хлорида гематина рвотные массы имеют вид кофейной гущи. Правда, при выраженной гипохлоргидрии, а также в тех случаях, когда желудочное кровотечение бывает профузным, рвотные массы сохраняют примесь неизмененной крови.
Лекция 10
Основные жалобы при заболеваниях кишечника. Общий осмотр, осмотр, перкуссия и пальпация живота при заболеваниях ЖКТ.
Экз. вопросы:
Основные жалобы пpи заболеваниях кишечника: причины и механизм возникновения, диагностическое значение.
Метеоризм: причины, детализация, диагностическое значение.
Диарея: виды, причины, механизмы возникновения, детализация, диагностическое значение.
Запор: виды, причины, детализация, диагностическое значение.
Данные общего осмотpа больных с заболеваниями ЖКТ, их диагностическое значение.
Данные осмотpа, перкуссии и пальпации живота больных с заболеваниями ЖКТ, их диагностическое значение.
Основные жалобы при заболеваниях кишечника:
Боль в животе
Вздутие кишечника – метеоризм
Урчание, переливание в кишечнике
Нарушения стула
Кровотечение.
Боль при заболеваниях тонкой кишки локализуются вокруг пупка, при заболеваниях толстой кишки – по периферии живота. По механизму возникновения выделяют следующие виды болей:
Спастическая – обусловлена спазмом гладкой мускулатуры кишечника. Возникает при воспалительных заболеваниях тонкой и толстой кишки (энтериты, колиты), глистных инвазиях, отравлениях солями тяжелых металлов (ртуть, мышьяк), начальных стадиях кишечной непроходимости. Спастическая боль по характеру резкая, приступообразная. Купируется или уменьшается после приема спазмолитиков.
Дистензионная боль – возникает при растяжении стенки кишки газом или большим объемом содержимого. Возникает при метеоризме, запорах, поздних стадиях кишечной непроходимости. Дистензионная боль тупая, ноющая, длительная. Возникает чаще во второй половине дня, что связано с суточным ритмом работы кишечника. Купируется после отхождения газов, дефекации.
Перитонеальная боль – обусловлена вовлечением в патологический процесс париетального листка брюшины. Выделяют 2 вида перитонеальной боли: острая и хроническая. Причинами острой перитонеальной боли являются перфорация стенки кишки при язвах тонкой или толстой кишки, болезни Крона, опухоли кишечника с распадом. Острая перитонеальная боль возникает внезапно, носит острый характер, интенсивность во времени ее нарастает. Причинами хронической перитонеальной боли являются спаечная болезнь и прорастание стенки кишки опухолью. Хроническая перитонеальная боль по характеру тупая, усиливается при движениях, перемене положения тела, после дефекации и очистительной клизмы.
Метеоризм – ощущение вздутия, распирания живота, связанное с избыточным скоплением газов в кишечнике.
В процессе пищеварения в кишечнике образуются газы, которые способствуют нормальному перемешиванию и продвижению химуса по кишечнику. Большая часть газов в норме всасывается через стенку кишки. Небольшое количество газов выделяется через прямую кишку.
При нарушении процессов образования газов, всасывания или выведения возникает метеоризм.
По механизму выделяют следующие виды метеоризма:
Алиментарный. Возникает при повышенном употреблении продуктов, богатых клетчаткой – бобовые, капуста, черный хлеб, молоко, виноград. При этом усиливаются процессы брожения углеводов в толстой кишке и повышается газообразование.
Дигестивный. Возникает при недостатке пищеварительных ферментов в тонкой кишке. Причинами являются заболевания ЖКТ с секреторной недостаточностью – гастриты, панкреатиты, диффузные заболевания печени – гепатиты, циррозы, заболевания ЖВП – ЖКБ.
Дисбиотический. Возникает при нарушении роста нормальной микрофлоры в кишечнике. При избыточном росте бактерий в тонкой кишке процессы газообразования начинаются уже в верхних отделах тонкой кишки, что приводит к повышенному газообразованию.
Циркуляторный метеоризм. Возникает при нарушении кровообращения в стенке кишки, в результате чего нарушается всасывание газов. Такой вид метеоризма наблюдается при правожелудочковой недостаточности, портальной гипертензии.
Динамический метеоризм. Его возникновение связано с нарушением моторики ЖКТ при дискинезии кишечника, кишечных инфекциях.
Механический метеоризм развивается при органическом сужении просвета кишки – опухолях, стенозах, спаечной болезни. При этом виде метеоризма нарушается выведение газов через прямую кишку.
Психогенный метеоризм развивается при неврозах, истерии за счет нарушения нервной регуляции двигательной активности ЖКТ. Возникающий при этом спазм гладкой мускулатуры приводит к нарушению всасывания и выведения газов.
Высотный. Возникает при подъеме на высоту и снижении атмосферного давления. Газы в кишечнике расширяются, их давление на стенку кишки увеличивается.
Метеоризм проявляется ощущением вздутия живота, сопровождается дистензионной болью, уменьшающейся после отхождения газов. Повышение давления в кишке может приводить к повышению давления в желудке, пищеводе и возникновению таких жалоб, как тошнота, отрыжка, снижение аппетита, неприятный вкус во рту. Обычно метеоризм сильнее выражен во второй половине дня.
Урчание, переливание в кишечнике.
Жалобы, характерные для поражения тонкой кишки. Механизм их возникновения связан с нарушением двигательной активности тонкой кишки и нарушением полостного пищеварения вследствие дефицита пищеварительных ферментов. Усиление перистальтики при этом приводит к увеличению скорости прохождения химуса, нарушению газообразования и процессов всасывания газов и появлению ощущения деятельности кишечника – урчания и переливания. Эти жалобы усиливаются во второй половине дня.
К нарушениям стула относят запоры и поносы.
Для заболеваний тонкой кишки более характерны поносы, или диарея.
Диареей называется:
Жидкий стул
Частый стул – более 2 раз в сутки.
Выделение каловых масс в большом объеме – полифекалия.
По механизму возникновения выделяют несколько видов диареи при заболеваниях тонкой кишки:
Моторная. Основным механизмом является первичное усиление моторики тонкой кишки вследствие нарушения нервной регуляции. Усиление перистальтики приводит к увеличению скорости прохождения химуса, нарушению переваривания и снижению всасывания нутриентов и воды в кишке. Причинами является невроз («медвежья болезнь»), тиреотоксикоз, синдром раздраженной кишки.
Характерно для этого вида диареи:
возникновение в утренние часы («понос-будильник»),
каловые массы в большом объеме – полифекалия,
не сопровождается водно-электролитными нарушениями.
Осмотическая. Механизм возникновения этого вида тонкокишечной диареи связан с дефицитом пищеварительных ферментов и нарушением полостного и пристеночного пищеварения. В результате чего в просвете кишки накапливается большое количество непереваренных нутриентов, обладающих высокой осмотической активностью. Они притягивают на себя воду из стенки кишки, увеличивается объем кишечного содержимого, вследствие чего усиливается моторика и возникает диарея. Причинами являются гастриты, панкреатиты с секреторной недостаточностью, диффузные заболевания печени, ЖКБ.
Для этого вида диареи характерно:
Четкая связь с приемом пищи: количество дефекаций соответствует количеству приемов пищи. При голодании диарея исчезает.
Характерна полифекалия
В каловых массах содержатся непереваренные кусочки пищи, зачастую кал имеет жирный блеск из-за нарушения переваривания жиров и неприятный запах.
Секреторная. Механизм связан с активной секрецией воды и электролитов из кишечной стенки в просвет кишки. Причинами являются чаще кишечные инфекции – холера, вирусные (ротавирус, аденовирус), бактериальные инфекции (сальмонеллы, кишечная палочка, шигеллы) и паразитарные инвазии – балантидии и др.
Токсины, вырабатываемые микроорганизмами, связываются со специфическими рецепторами энтероцитов, вызывая активацию цАМФ. При этом происходит усиленная секреция воды и электролитов в просвет кишки. Подобным действием обладают желчные кислоты и гормоны (серотонин, кальцитонин, гастрин). Поэтому секреторная диарея возникает при опухоли поджелудочной железы – гастриноме, опухоли паращитовидных желез с повышенной выработкой указанных гормонов.
Для этого вида диареи характерно:
Отсутствие связи с приемом пищи. При голодании секреторная диарея не исчезает.
Каловые массы водянистые с хлопьями, их количество достигает несколько литров в сутки.
Сопровождается потерей воды и электролитов.
Экссудативная. Механизм этого вида диареи связан с экссудативным воспалением тонкой кишки. Возникает при болезни Крона, неспецифическом язвенном колите, ишемических повреждениях кишечника.
Для этого вида диареи характерно:
Каловые массы в небольшом объеме, кашицеобразные, содержат примесь слизи
Стул частый. Частота стула зависит от активности воспаления в стенке кишки.
Сопровождается болью в животе, лихорадкой, внекишечными проявлениями, свидетельствующими об активности процесса: артритами, кожными высыпаниями.
Может развиться гипопротеинемия в связи с потерей белка с экссудатом.
Диарея также может наблюдаться при заболеваниях толстой кишки. Отличия толстокишечной диареи от диареи при заболеваниях тонкой кишки:
Частота стула: при толстокишечной диарее достигает 20-30 раз в сутки.
Объем каловых масс: при толстокишечной диарее небольшой, с примесями слизи, крови, гноя.
Сопровождается тенезмами – ложными болезненными позывами к дефекации без выделения каловых масс. Тенезмы обусловлены раздражением воспаленной слизистой прямой кишки и являются признаком поражения дистальных отделов кишечника.
Запоры – обстипационный синдром. Больше характерен для поражений толстой кишки.
Запор – это:
Редкий стул – стул реже 1 раза в 2 суток или реже 4 раз в неделю.
Малый объем каловых масс: менее 100 г в сутки
Плотный твердый кал
Затрудненный акт дефекации
По механизму выделяют:
Алиментарные запоры. Возникают при употреблении малого объема пищи, сухоедении, малом употреблении продуктов, содержащих клетчатку. При этом объем кишечного содержимого уменьшается, снижается перистальтика и возникает запор.
Органические (механические) запоры. Возникают при наличии механического препятствия по ходу продвижения каловых масс: опухоли, стенозы, дивертикулы, спайки.
Функциональные запоры. Возникают при нарушении моторной функции толстой кишки. В норме моторная функция кишечника осуществляется при согласованной работе циркулярной и продольной мускулатуры.
При повышении тонуса циркулярных мышц кишечной стенки развиваются спастические функциональные запоры. При этом нарушается продвижение кишечного содержимого из-за спазма кишки. Спастические запоры сопровождаются спастической болью по ходу толстой кишки, стул может быть ежедневным, но каловые массы повышенной плотности, выделяются в малом объеме небольшими комочками – «овечий кал». После дефекации возникает чувство неполного опорожнения кишечника.
При снижении тонуса продольной мускулатуры кишечника возникают гипомоторные функциональные запоры. Нарушение продвижения кишечного содержимого при этом связано со снижением пропульсивной активности толстой кишки. Длительное пребывание химуса в толстой кишке приводит к повышению всасывания воды из кишечного содержимого. Гипомоторные запоры болью обычно не сопровождаются. Стул редкий, кал выделяется в большом объеме, повышенной плотности, для совершения акта дефекации необходимы дополнительные усилия или прием специальных поз.
Функциональные запоры развиваются при нарушении нервной регуляции моторной функции кишечника – при неврозах, гипотиреозе, сахарном диабете, заболеваниях нервной системы, отравлениях тяжелыми металлами – ртуть, свинец.
4. Аноректальные запоры. Возникают при нарушении рефлекса и координированной работы мышц прямой кишки, анального сфинктера и мышц тазового дна во время акта дефекации. Причинами служат заболевания прямой кишки – геморрой, трещины прямой кишки, проктиты. Аноректальные запоры могут развиться у людей, постоянно сдерживающих акт дефекации, например, на работе, в результате чего происходит дискоординация в работе мышц кишки и тазового дна – «привычные запоры». Еще одна из причин аноректальных запоров – болезнь Гиршпрунга – это врожденное заболевание, отсутствие нервных ганглиев в участке прямой кишки. Эта часть прямой кишки не участвует в продвижении каловых масс, что приводит к вышележащему скоплению кала и расширению кишки.
Лекция: РАССПРОС БОЛЬНОГО С ЗАБОЛЕВАНИЕМ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
Значение расспроса в диагностике заболеваний печени и желчевыводящих путей.
Сложная функция печени определяет разнообразную симптоматику ее патологических состояний. Большая часть симптомов, облегчающих диагностику этой группы заболеваний, выявляется уже при клиническом обследовании больного и формирует основные синдромы.
Основные жалобы при заболеваниях печени и желчевыводящих путей, механизм возникновения, диагностическое значение.
Основные жалобы:
- боли
- желтушное окрашивание кожи и слизистых оболочек
- изменение цвета мочи и кала
- кожный зуд
- увеличение размеров живота
- симптомы диспепсии
- геморрагии
- лихорадка
- астенический синдром
Боль
Необходимо отдельно рассматривать боль:
- при заболеваниях печени
- при заболеваниях ЖП и ЖВП
Боль при заболеваниях печени
- дистензионная (связанная с растяжением глиссоновой капсулы печени). Растяжение капсулы может быть острым, что бывает при тромбозе вен печени (синдром Бадда-Киари), ТЭЛА, тромбоэмболии НПВ. Растяжение может быть медленным, постепенным, что встречается при гепатитах, циррозах, опухолях (первичных и Mts), ХСН.
Дистензионные боли по характеру ноющие, тупые, тянущие, малоинтенсивные, в виде чувства давления, распирания в области правого подреберья, не стихают после приема спазмолитиков. Как правило, без четкой иррадиации.
- боль от непосредственного поражения глиссоновой капсулы (вовлечение ее в патологический процесс), что встречается при перигепатитах, поверхностно расположенном абсцессе печени, прорастании опухоли. Эти боли имеют более четкую локализацию, более интенсивные, чем дистензионные, усиливаются при ходьбе, тряской езде и перемене положения тела.
Боль при заболеваниях ЖП и ЖВП
- спастическая боль при заболеваниях желчевыводящих путей связана со спазмом гладкой мускулатуры желчного пузыря и сфинктера Одди или спазм циркулярной мускулатуры в области шейки желчного пузыря.
Спастическая боль - это желчная или билиарная колика.
По характеру острые, приступообразные, внезапно начинаются и нередко также внезапно заканчиваются, очень интенсивные, обычно четко локализованные, провоцируются приемом жирной пищи и тряской ездой, с типичной иррадиацией в правое плечо, лопатку и межлопаточное пространство (вверх, вправо и кзади). Данная иррадиация объясняется тем, что правый диафрагмальный нерв, обеспечивающий чувствительную иннервацию фиброзной оболочки печени и области серповидной связки, венечной связки и внепеченочных желчных путей, берет начало в тех же сегментах спинного мозга, что и чувствительные нервы, иннервирующие шею и плечо, а при переходе возбуждения на эти нервы и объясняет данную иррадиацию боли. Боли ослабевают после приема спазмолитиков. Могут сопровождаться рвотой, часто не приносящей облегчение, лихорадкой (рефлекторного генеза) и локальным напряжением мышц брюшной стенки (перивесцириты). Спастическая боль возникает при ЖКБ и провоцируется приемом жирной пищи и тряской ездой, при дисфункции ЖП или сфинктера Одди по гиперкинетическому типу, холецистите, паразитарных инвазиях (описторхоз, клонорхоз).
- дистензионная боль связана с растяжением стенок желчного пузыря и ЖВП, что связано с нарушением оттока желчи и ведет к повышению давления в ЖП и ЖВП и растяжению стенок ЖП и стенок протоков.
По характеру боли ноющие, тупые, тянущие, малоинтенсивные, в виде чувства давления, распирания в области правого подреберья, в точке ЖП, не стихают после приема спазмолитиков, провоцируются редкими приемами пищи, жирной, жаренной пищей и обильными приемами пищи. Как правило без четкой иррадиации. Возникают при нарушении оттока желчи при обтурации конкрементом, при формировании стриктуры, стеноза холедоха, стеноза БДС, папиллит, опухоли БДС, опухоли поджелудочной железы, сдавление ЖВП из вне увеличенными лимфатическими узлами, при дисфункции ЖП или сфинктера Одди по гипокинетическому типу.
- перитонеальная боль возникает при переходе воспалительного процесса на париетальную брюшину. Бывает острая и хроническая.
Острая перитонеальная боль – это признак острой хирургической патологии (перфорация ЖП камнем, флегманозный и гангренозный холецистит и т.д.). Острая перитонеальная боль часто сопровождается общими признаками воспаления и интоксикации (лихорадка, лейкоцитоз и т.д.), рвотой, ограничением дыхательных движений живота, напряжением мышц передней брюшной стенки, положительным симптомом Щеткина-Блюмберга и ослаблением (исчезновением) перистальтики.
Хроническая перитонеальная боль возникает при переходе воспалительного процесса на париетальную брюшину. Часто встречается при хроническом холецистите, перихолецистите, при прорастании опухоли. Хронические перитонеальные боли возникаю постепенно, постоянные, непрерывно усиливающиеся вплоть до непереносимых.
Желтушное окрашивание кожи и слизистых оболочек
Желтуха ложная (псевдожелтуха, каротиновая желтуха) — желтушное окрашивание кожи (но не слизистых оболочек!) вследствие накопления в ней каротинов при длительном и обильном употреблении в пищу моркови, свеклы, апельсинов, тыквы, облепихи и других продуктов с большим количеством каротинов, а также возникающая при приеме внутрь акрихина, контакт с пикриновой кислотой и некоторых других препаратов.
.Желтуха (истинная) — симптомокомплекс, характеризующийся желтушным окрашиванием кожи и слизистых оболочек, обусловленный накоплением в тканях и крови билирубина.
Истинная желтуха может развиться в результате трёх основных причин:
