
- •Тема1: основные понятия и законы химии Пример 1
- •Эквивалентные молярные массы кислорода и хлора находим из выражения
- •Пример 2 к раствору, содержащему сульфат меди массой 30 г, прилили раствор, содержащий 8 г сульфида натрия. Определите массу выделившегося осадка.
- •Тема 2: растворы
- •2.1. Способы выражения количественных соотношений между компонентами системы
- •Пример 4
- •Ιι способ
- •Из выражения
- •Ιιι способ (метод креста)
- •2.2. Растворы неэлектролитов
- •2.3. Растворы электролитов
- •2.4. Водородный показатель среды
- •2.5. Гидролиз
- •Тема 3 : энергетика химических процессов
- •Тема 4: химическая кинетика химическое равновесие
- •Тема 5 : окислительно-восстановительные процессы
- •Тема 6: электрохимические процессы
- •6.1. Гальванический элемент
- •6.2. Направление протекания окислительно-восстановительных реакций
- •6.3. Электролиз
- •6.4. Коррозия металлов
- •Тема 7: строение атома. Химическая связь
Тема 4: химическая кинетика химическое равновесие
Пример 12
При 25 0С некоторая реакция заканчивается за 4 минуты. Вычислите, через какое время завершится данная реакция, если ее проводить при 45 0С. Температурный коэффициент реакции равен 3.
Дано: 1= 4 мин. t 1 = 25 0С t 2 = 45 0С =3 |
Решение Из выражения (4.4) найдем, во сколько раз увеличилась скорость реакции при повышении температуры V2 (t2–t1)/10 (45–25)/10 = = 3 = 32 = 9 V1 |
2 = ? |
Так как скорость реакции обратно пропорциональна |
1 4·60
времени, то 2 = = = 26,7 (с.)
9
Ответ: 2 = 26,7 с.
Пример 13
При некоторой температуре константа равновесия реакции
СO + С12 СOС12 равна 40. Равновесные концентрации СO и СOС12 равны 0,2 моль/л и 0,8 моль/л соответственно. Вычислите исходную концентрацию хлора.
Дано: К = 40 [СО] = 0,2 моль/л [СOС12] = 0,8 моль/л |
Решение
СO + С12 СOС12
Из выражения константы равновесия реакции определим равновесную концентрацию хлора [С12]
|
С(С12) = ? |
[СOС12] 0,8 К = = = 40 |
[СO] [С12] 0,2[С12]
[С12] = 0,1
Исходная концентрация хлора будет складываться из количества хлора, вступившего в реакцию, а также оставшегося в равновесной смеси.
С(С12) = [С12] + С(С12)
По уравнению реакции при образовании 1 моля фосгена расходуется
1 моль хлора. Следовательно, при образовании 0,8 моля СOС12 было израсходовано 0,8 моля С12
С(С12) = 0,1 + 0,8 = 0,9 (моль/л)
Ответ: С(С12) = 0,9 моль/л.
Тема 5 : окислительно-восстановительные процессы
Пример 14
Используя метод электронного баланса, расставить коэффициенты в уравнении реакции:
As2S3 + HNO3 + H2O H3AsO4 + H2SO4 + NO
Решение.
Определяются степени окисления элементов в соединениях:
+3 –2 +1 +5 –2 +1 –2 +1 +5 –2 +1 +6 –2 +2 –2
As2 S3 + H N O3 + H2O H3 As O4 + H2 S O4 + N O.
Из схемы реакции видно, степень окисления азота уменьшается от +5 до +2, следовательно, происходит процесс восстановления (HNO3 – окислитель), а степени окисления повышаются сразу у двух элементов: у мышьяка от +3 до +5 и у серы от минус 2 до +6, следовательно, эти два элемента в процессе реакции окисляются (As2S3 – восстановитель).
Составляем электронные уравнения и добиваемся электронного баланса, учитывая индексы при атомах мышьяка и серы и суммируя число отданных электронов (принято 3 электрона, а отдано 24 + 4 = 28 электронов):
+ 5 +2
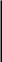 N
+ 3ē = N 28
N
+ 3ē = N 28
+3 +5
2 As – 4ē = 2 As 3
–2 +6
3 S – 24 ē = 3 S 3
Перенесем основные коэффициенты в уравнение реакции:
3As2S3 + 28HNO3 + H2O 6H3AsO4 + 9H2SO4 + 28NO,
а затем найдем коэффициент при H2O.
Окончательно уравнение будет иметь вид
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO.
Пример 15
Реакция протекает в кислой среде:
K MnO4 + H2S + H2SO4 MnSO4 + S + K2SO4 + H2O .
О кислитель
MnO4
восстанавливается в кислой среде до
Mn2+, а восстановитель H2S
окисляется до S: по ионно-электронному
уравнению:
кислитель
MnO4
восстанавливается в кислой среде до
Mn2+, а восстановитель H2S
окисляется до S: по ионно-электронному
уравнению:
MnO4 + 8 H+ + 5e = Mn2+ + 4 H2O 2
H2S – 2e = S + 2H+ 5
Суммируем эти полуреакции, предварительно умножая их соответственно на 2 и 5 :
2 MnO4 + 16 H+ + 5H2S = 2 Mn2+ + 5 S + 8 H2O + 10H+ .
Правильно подобрав члены, получим уравнение окислительно-восстановительной реакции в ионно-молекулярном виде
2 MnO4 + 6 H+ + 5H2S = 2 Mn2+ + 5 S + 8 H2O .
Для получения уравнения в молекулярном виде следует добавить к каждому аниону соответствующий катион, а к каждому катиону – анион:
2 КMnO4 + 5H2S + 3 H2SO4 = 2 MnSO4 + 5 S + K2SO4 + 8 H2O
