
- •Тема1: основные понятия и законы химии Пример 1
- •Эквивалентные молярные массы кислорода и хлора находим из выражения
- •Пример 2 к раствору, содержащему сульфат меди массой 30 г, прилили раствор, содержащий 8 г сульфида натрия. Определите массу выделившегося осадка.
- •Тема 2: растворы
- •2.1. Способы выражения количественных соотношений между компонентами системы
- •Пример 4
- •Ιι способ
- •Из выражения
- •Ιιι способ (метод креста)
- •2.2. Растворы неэлектролитов
- •2.3. Растворы электролитов
- •2.4. Водородный показатель среды
- •2.5. Гидролиз
- •Тема 3 : энергетика химических процессов
- •Тема 4: химическая кинетика химическое равновесие
- •Тема 5 : окислительно-восстановительные процессы
- •Тема 6: электрохимические процессы
- •6.1. Гальванический элемент
- •6.2. Направление протекания окислительно-восстановительных реакций
- •6.3. Электролиз
- •6.4. Коррозия металлов
- •Тема 7: строение атома. Химическая связь
2.3. Растворы электролитов
Пример 7
Кажущаяся степень диссоциации MgCl2 в 0,1 н растворе равна 75%. Вычислите изотонический коэффициент этого раствора.
Дано: = 75% С = 0,1 н MgCl2 |
Решение Из выражения i – 1 = n – 1 |
i. = ? |
находим изотонический коэффициент |
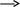
 MgCl2
Mg2+ + 2С1
n = 3
MgCl2
Mg2+ + 2С1
n = 3
Преобразуем выражение (1)
n – 1) = i – 1
n – 1) + 1 = i
0,75(3-1) + 1 = i , i = 2,5
Ответ: i = 2,5
2.4. Водородный показатель среды
Пример 8
Вычислите рН и рОН 0,01 М раствора хлоруксусной кислоты
СН2С1СООН (КДИС = 1,4•10-5)
Дано: С = 0,01 М КДИС = 1,4•10-5 СН2С1СООН |
Решение рН = –lg [H+] [H+] = К C = 1,4•10-5•10-2 = 3,5•10-4 рН = –lg3,5•10-4 = 4 – lg3,5 = 4 – 0,5441 = 3,4559 |
рН. = ? рОН. = ? |
рОН. = 14 – 3,4559 = 10,5441 |
2.5. Гидролиз
Пример 9
Запишите уравнение гидролиза раствора соли Na2S по первой ступени и укажите, какими факторами можно усилить гидролиз:
добавлением хлорида натрия
добавлением соляной кислоты
повышением температуры.
Решение
Гидролиз соли сульфида натрия идет по аниону

 Na2S
+ НОН NaОН
+ NaНS
Na2S
+ НОН NaОН
+ NaНS
 2
Na+ +
S2- +
НОН Na+
+ ОН-
+ Na+
+ НS-
2
Na+ +
S2- +
НОН Na+
+ ОН-
+ Na+
+ НS-

 S2-
+ НОН ОН- + НS-
рН >7
S2-
+ НОН ОН- + НS-
рН >7
При добавлении хлорида натрия в раствор Na2S никаких изменений в процессе гидролиза не происходит.
При добавлении НС1 происходит нейтрализация ионов ОН- и равновесие смещается в сторону прямой реакции – гидролиз усиливается.
При повышении температуры гидролиз усиливается.
Тема 3 : энергетика химических процессов
Пример 10
При взаимодействии 2,1 г железа с серой выделилось 3,77 кДж теплоты. Рассчитайте теплоту образования сульфида железа (II).
Дано: m (Fe) = 2,1 г H1 = – 3,77 кДж |
Решение Запишем уравнение реакции: Fe + S = FeS |
Н0298 (FeS) = ? |
Из уравнения реакции следует, что один моль сульфида железа образуется из одного моля железа. Следовательно, можно определить количество вещества FeS, зная, что М (Fe) = 56 г/моль: |
ν (FeS) = ν (Fe) = m/М = 2,1 / 56 = 0,0375 (моль)
Тогда Н0298 (FeS) = H1 / ν = (–3,77) / 0,0375 = – 100,5 (кДж/моль)
Ответ : Н0298 (FeS) = – 100,5 кДж/моль
Пример 11
Вычислите теплоту образования Н0298 пропана C3Н8, если известно, что при сгорании 11 г его выделяется 554 кДж теплоты.
Дано: m (C3Н8) = 11 г H1 = – 554 кДж |
Решение Запишем уравнение реакции сгорания пропана: C3Н8 (г) + 5O2 (г) = 3СO2 (г) + 4H2O (ж) |
Н0298 (C3Н8) = ? |
Определяем количество сгоревшего пропана |
ν (C3Н8) = m/М = 11 / 44 = 0,25 (моль)
Далее находим тепловой эффект реакции
Н = H1 / ν = (–554) / 0,25 = – 2216 (кДж/моль)
По закону Гесса находим теплоту образования пропана, используя уравнение реакции:
Н = 3Н0298 (СO2) + 4Н0298 (H2O) – Н0298 (C3Н8) – 5Н0298 (O2) (1)
По справочнику находим (кДж/моль):
Н0298 (СO2) = – 393,5; Н0298 (H2Oж) = – 286,0; Н0298 (O2) = 0.
Подставляем эти значения в выражение (1).
–2216 = 3· (– 393,5) + 4·(– 286,0) –Н0298 (C3Н8) – 5·0.
Н0298 (C3Н8) = – 108,5 (кДж/моль).
Ответ: Н0298 (C3Н8) = = – 108,5 кДж/моль.
