
- •Хімічні датчики
- •1. Огляд
- •2 . Історія
- •3. Характеристики хімічних датчиків
- •4. Класи хімічних датчиків
- •4.1 Електричні та електрохімічні перетворювачі
- •4.2. Полімерні хеморезистори
- •4.3 Фото іонізаційний детектор
- •4.4 Фізичні перетворювачі
- •4.5 Оптичні датчики
- •5 Біохімічні датчики
- •5.1 Ферментні датчики
- •6 Мультисенсорні матриці
- •7. Електронні прилади запаху і смаку
- •8. Конкретні проблеми
4. Класи хімічних датчиків
Не існує загальноприйнятого методу класифікації всіх хімічних датчиків. Для цілей цієї глави, ми розділили їх на дві основні групи: одна група – це метод здійснення перетворення (трансдукції), а інша - метод реалізації. Далі ми розділили методи трансдукції на три класи, в тому числі (1) - датчики, що вимірюють електричні або електрохімічні властивості, (2) - ті, які вимірюють зміну фізичних властивостей, (3) - ті, що базуються на оптичному поглинанні. Був розроблений вражаючий діапазон сенсорних технологій, для отримання відгуку на різні хімічні, фізичні та оптичні властивості для виявлення хімічних речовин. Деякі з цих технологій, наприклад мікроконсолів, можуть бути використані для вимірювання хімічних та/або фізичних властивостей і, отже, не так легко класифіковані.

Рис. 3. Відгук ємнісного сенсорного масиву VОС, що містить сім по різному поглинаючих хемоконденсаторів з полімерним покриттям на імпульси ацетону, метилетилкетону, толуолу, етанолу і води при 25°С
4.1 Електричні та електрохімічні перетворювачі
Датчики, які безпосередньо вимірюють електричні властивості певної речовини або вплив аналізованої речовини на електричні властивості іншої речовини часто є недорогими комерційно доступними детекторами. За допомогою цих датчиків, виявлення може бути оборотним або необоротним руйнівним процесом, що призводить до розкладання аналізованої речовини. Ці датчики та допоміжна електроніка, як правило, прості по конструкції і в результаті прилади на їх основі ймовірно можуть бути використані в жорстких умовах. Датчики цього класу включають метал-оксидні напівпровідники, електрохімічні датчики, потенціометричні датчики, кондуктометричні і амперометричні датчики, еластомірні хеморезистори, хемоконденсатори, хімічні польові транзистори.
4.1.1. Метал-оксидні напівпровідникові пристрої
У найбільш поширених типах датчиків на метал-оксидних напівпровідниках (МОН) відбувається перетворення зміни концентрації активних частинок у зміну опору. Розробка цих датчиків почалася більше 50 років тому, коли вчені виявили, що питомий опір напівпровідника змінюється зі зміною навколишнього хімічного середовища [9]. Для створення першої моделі датчика був використаний германій, який чітко реагував на зміну вимірюваного опору, але з ряду причин були проблеми з відтворюваністю. Сьогодні метал-оксидні датчики є комерційно доступними, недорогими, надійними, і використовуються в різних прикладних задачах. Датчик на основі метал-оксиду, як правило, складається з напівпровідникового чутливого шару, електричних контактів для вимірювання опору цього шару, і нагрівача для регулювання температури датчика [9]. Після хемосорбції хімічно активних молекул на поверхні оксиду металу, відбувається перенесення заряду. Коли метал-оксидні кристали, такі як SnO2, нагрівають на повітрі до певної, досить високої температури, кисень адсорбується на поверхні кристала, і формується поверхневий потенціал, який перешкоджає потоку електронів. Коли поверхня піддається впливу газів, що окислюються, таких як водень, метан і окис вуглецю, поверхневий потенціал зменшується, і провідність помітно збільшується [10]. У міру збільшення концентрації аналізованого компонента, змінюється величина опору.
Співвідношення між електричним опором плівки і заданою концентрацією газу описується таким емпіричним рівнянням:
Rs = AC-α , (1)
де Rs - є електричним опором датчика, А - є специфічною постійної для даного складу плівки, С - концентрація газу, і α - є характеристичним нахилом кривої Rs для цього матеріалу і аналізованого газу [11].
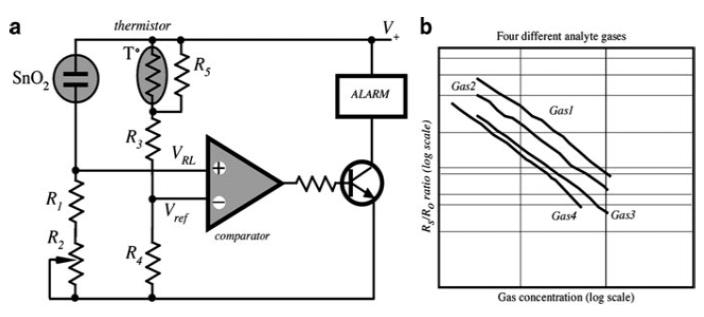
Рис. 4. Міст Уітстона для метал-оксидного SnO2 датчика (а) і його відгуки на різні гази (b)
Метал-оксидні пристрої змінюють свій опір залежно від присутності газу, що окислює і як такі, вимагають додаткової електронної схеми для своєї роботи. Типова схема полягає у включенні датчика в одне з плечей мостової схеми Уітстона, так що зміна опору може бути виміряна як різниця потенціалів в діагоналі мостової схеми (Рис. 4a). Для настройки точки рівноваги моста в залежності від температури датчика необхідний NTC терморезистор 2 з лінеаризуючим паралельним резистором. Оскільки датчик поводиться як змінний резистор, опір якого змінюється залежно від виду та концентрації газу, падіння напруги на ньому пропорційно його опору. Таким чином реєструється падіння напруги в мостовій схемі в залежності від концентрації газу. Сигнал відгуку від датчиків лінійний, коли він приводиться в логарифмічному масштабі (4b). Нахили і зміщення робочих кривих, викликані впливом різних окислюваних газів, дозволяють відрізняти їх один від одного і визначати їх кількість в певних діапазонах концентрацій, де криві не перетинаються [12]. Додатково можна використовувати швидкість зміни провідності для розрізнення газів і концентрацій [13]. Об'ємна провідність може дрейфувати для цих пристроїв, але швидкість зміни провідності, коли вона управляється вхідними імпульсами, є більш стабільною і відтворною.
Ці твердотільні датчики мають ту перевагу, що вони невеликі, мають низьку споживану потужність, низьку вартість і можуть бути легко виготовлені методом групової технології. Схема контролю і вимірювання може бути реалізована на кремнієвій мікросхемі, що також, забезпечує можливості для створення модульних датчиків, які містять монолітно інтегровану матрицю чутливих елементів разом з системою збору даних і управлінням, розташованою на тому ж кристалі. З'явилися кілька посилань на тонко і товсто плівкові датчики на кремнієвій підкладці на основі різних матеріалів для вимірювання різних газів [14, 15]. Оксид олова є найбільш вивченим і поширеним бездомішковим плівковим матеріалом [16, 17, 18, 19, 20]. Крім того, плівки оксиду олова леговані Pt [21, 22] і Pd [23, 24] були використані для вимірювання окису вуглецю, водню, вуглеводнів. Титан, в різних формах і середовищах, був використаний для вимірювання кисню [25]. Родій легований TiO2 використовується для визначення водню [26]. Оксид цинку був використаний для детектування водню, чадного газу та вуглеводнів [27]. Електричні властивості цих матеріалів змінюються з адсорбцією, абсорбцією, десорбцією, перегрупуванням і реакціями газів на поверхні або в об'ємі. Багато з цих матеріалів мають каталітичні властивості, і також адсорбція і/ або поверхневі реакції газів сприяють зміні електричної провідності.
4.1.2 Електрохімічні датчики
Електрохімічні датчики є комерційно доступними і універсальними. Залежно від режиму роботи, вони поділяються на датчики, що генерюють напругу (потенціометричні), ті, які змінюють свій електричний струм (амперометричні) і ті, що грунтуються на вимірюванні провідності або опору (кондуктометричні). У всіх цих методах використовуються спеціальні електроди, де або відбувається хімічна реакція, або перенесення заряду модулюється реакцією.
Фундаментальне правило електрохімічного датчика є те, що він завжди вимагає закритого контуру, тобто електричний струм (постійний або змінний), повинен мати можливість протікати для проведення вимірювань. Оскільки для протікання електричного струму необхідний замкнутий контур, датчику необхідно мати, щонайменше, два електроди, один з яких називається відновлюваним електродом.
Слід зазначити, однак, що навіть якщо в потенціометричному датчику не потрібно протікання струму, ланцюг все ж повинен бути замкнутим при вимірюванні напруги.
Електроди в цих сенсорних системах часто виготовляються з каталітичних металів, таких як платина або паладій, або вони можуть бути металопокритим вуглецем. Електроди сконструйовані таким чином, щоб мати велику площу поверхні, для того, щоб реагувати з такою кількістю аналізованої речовини, з якою тільки можливо, виробляючи достатню величину вимірюваного сигналу. Електроди можна видозмінювати, щоб поліпшити швидкість реакції і продовжити їх тривалість життя. Цільові хімічні реакції відбуваються на робочому (індикаторному) електроді (WE) (Рис. 5). Електричний сигнал вимірюється по відношенню до вимірювального або допоміжного (лічильного) електрода (AE), який не є каталітичним, а у випадку трьох електродних систем, третій електрод порівняння (RE) використовується для вимірювання та корекції електрохімічних потенціалів, що генеруються кожним електродом і електролітом. Третій електрод покращує функціонування шляхом корекції помилок, що вносяться поляризацією робочого електрода. Нові електрохімічні датчики використовують товстоплівковий трафаретний друк набору електродів, щоб зробити виробництво більш простим і надійним.
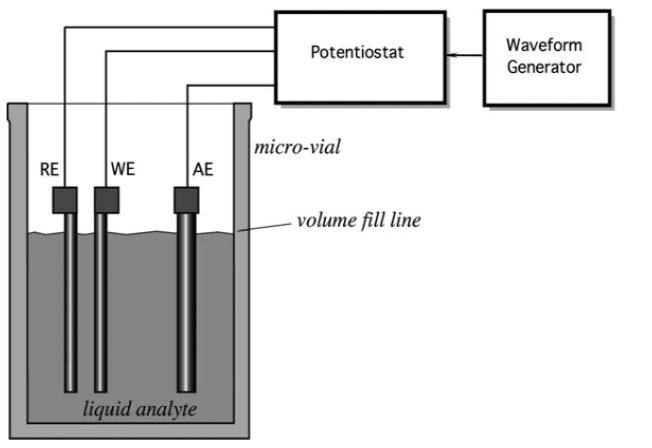
Рис. 5. Комплект електродів електрохімічного датчика.
Електроліт є середовищем, яке переносить заряд з використанням іонів замість електронів. Це безпосередньо обмежує реакції, які можуть мати місце, і є першим етапом підвищення селективності електрохімічного датчика. Датчик, утворений цим набором електродів і електролітів називається електрохімічною коміркою і може працювати в залежності від його електричних параметрів (зміни його опору, потенціалу, струму, ємності тощо). Більш достовірні результати вимірювань можуть бути отримані за допомогою різних типів вольтамперометрії, які й обговорюються далі в цьому розділі.
Простий рідинний електрохімічний сенсор використовує два електроди, занурені у розчин електроліту. Аналізовані гази, такі як СО, реагують на робочому електроді і виробляють CO2 і вільні електрони. Заряди і заряджені частинки мігрують на інший (лічільний) електрод, де виділяється вода, якщо присутній кисень. Ця реакція перетворює СО в СО2. Якщо електроди з'єднані послідовно з резистором і вимірюється падіння потенціалу на резисторі, то воно буде пропорційно струму, що протікає, і концентрації аналізованого газу.
CO + H2O → CO2 + 2H + +2 e- (2)
4.1.3 Потенціометричні датчики
Ці датчики використовують ефект рівноважної концентрації у випадку окислювально-відновних реакцій, що протікають на межі розділу електрод - електроліт в електрохімічному середовищі. Електричний потенціал може виникати на цій межі через окислювально-відновлювальну реакцію, яка відбувається на поверхні електрода, де Ox позначає окислювач, Ze- - кількість електронів, залучених до окислювально-відновлювальної реакції, і Red позначає відновлений продукт [28]:
Ox + Ze- = Red. (3)
Ця реакція відбувається на одному з електродів (катодна реакція в даному випадку) і називається напівелементною реакцією. При термодинамічних квазірівноважних умовах можна скористатися рівнянням Нернста, яке може бути записано як
E = E0 + RT/nF·lnC0*/CR*, (4)
де C0* і CR*є концентраціями Ох і Red, відповідно, n - число перенесених електронів, F є постійною Фарадея, R - газова постійна, T є абсолютною температурою і E0 є електродним потенціалом в стандартному стані. У потенціометричних датчиках, дві реакції будуть протікати одночасно на кожному електроді. Однак тільки одна з реакцій повинна включати аналізовану речовину, що нас цікавить; інша напівелементна реакція, переважно оборотна, не інтерферуюча і відома.
Вимірювання потенціалу комірки потенціометричного датчика повинне проводитися при нульовому струмі або квазірівноважних умовах, таким чином, потрібен, як правило, дуже високий вхідний імпеданс підсилювача (який називають електрометром). Існують два види електрохімічного інтерфейсу з точки зору переносу заряду: повністю поляризованого (чисто ємнісного) і неполяризованого. Деякі метали (наприклад, Hg, Au, Pt) при контакті з розчинами, що містять тільки інертний електроліт (наприклад, H2SO4) наближаються до поведінки ідеально поляризованого інтерфейсу. Проте, навіть у цих випадках в такому інтерфейсі існує опір обмеженому переносу заряду і надлишок витоку заряду з постійною часу τ, яка задається двошаровою ємністю і опором переносу заряду (τ = RctCdl).
Іоноселективні мембрани є ключовим компонентом всіх іонних потенціометричних датчиків. Вони встановлюють опорний сигнал, з яким датчик відгукується на цікаві для нас іони в присутності інших різних іонних компонентів у зразку. Іонноселективні мембрани утворюють неполяризований інтерфейс з розчинами. Добре зарекомендували себе мембрани (як стабільні, відтворювані, що мають імунітет до адсорбції і вихрових ефектів, а також селективні), які мають високі як абсолютні, так і відносні обмінні щільності струму.
4.1.4 Кондуктометричні датчики
Електрохімічний сенсор провідності вимірює зміну провідності електроліту в електрохімічній комірці. Електрохімічний сенсор може мати ємнісний імпеданс в результаті поляризації електродів, фарадичного процесу або переносу заряду.
У гомогенному розчині електроліту, провідність електроліту G (в Ω), обернено пропорційна L, яка є довжиною розчину уздовж електричного поля, і прямо пропорційна А, яка є площею поперечного перерізу перпендикулярно електричному полю [29]:
G = ρA/L, (4)
де ρ (в Ω/см ) питома провідність електроліту, пов'язана кількісно з концентрацією і величиною заряду іонних частинок. Згідно з Kohlrausch [30], еквівалентна провідність розчину при будь-якій концентрації C в моль/л, або в будь-яких інших зручних одиницях, дається
Λ = Λ0β √C, (5)
де β є характеристикою електроліту, а Λ0 є еквівалентною провідністю електроліту при нескінченному розведенні.
Методи вимірювання електролітичної провідності по електрохімічній питомій провідності датчика залишаються практично незмінними впродовж багатьох років. Зазвичай використовується міст Уітстона (аналогічний, наведеному на рис. 4) разом з електрохімічною коміркою (датчиком), яка формує один з опорів плеча моста. Однак, на відміну від вимірювання провідності твердої речовини, вимір провідності електроліту часто ускладнюється поляризацією електродів при робочій напрузі. Фарадичний процес або процес переносу заряду відбувається на поверхні електродів. Тому провідність датчика повинна вимірюватися при напрузі, при якій фарадичний процес не може відбутися. Іншим важливим фактором є утворення подвійного шару, прилеглого до кожного з електродів, коли потенціал прикладається до комірки. Це описується так званим імпедансом Варбурга. Таким чином, навіть за відсутності фарадичного процесу, важливо брати до уваги ефект подвійного шару під час вимірювання провідності. Вплив фарадичного процесу може бути зведений до мінімуму шляхом підтримки високої постійної комірки датчика L/А, так щоб опір комірки лежав би в області від 1 до 50 kΩ . Це передбачає використання невеликої площі поверхні електрода і великої міжелектродної відстані. Це, однак , знижує чутливість моста Уітстона. Часто вирішенням питання є використання комбінації конфігурацій електродів. Ефекти подвійних шарів і фарадичних процесів можуть бути зведені до мінімуму за допомогою використання високочастотного змінного струму малої амплітуди. Іншим хорошим рішенням може бути балансування ємності і опору комірки при з'єднанні змінного конденсатора паралельно опору моста, приєднаного до комірки.
4.1.5 Амперометричні датчики
Прикладом амперометричного датчика може бути хімічний датчик кисню Кларка, який був запропонований в 1956 р. [31]. Принцип роботи електрода базується на основі використання розчину електроліту, розміщеного в електродній збірці для перенесення кисню з кисневмістної мембрани до металевого катода. Катодний струм виникає в результаті двоступеневого, киснево-відновлювального процесу, який може бути представлений як
O2 +2H2O + 2e- → H2O2 +2 OH¯ H2O2 + 2e- → 2OH¯. (7)
Рис. 6а показує мембрану, яка натягується паралельно сферичному електроду, що дозволяє кисню дифундувати через тонкий шар електроліту до катоду. Анод і катод розміщені всередині збірки датчика і електричний контакт із зовнішньою речовиною відсутній. Рис. 6b ілюструє дифузійну модель електрода Кларка першого порядку [32]. Система мембрана - електроліт - електрод діє як одномірна дифузійна система з парціальним тиском на поверхні мембрани, рівним рівноважного парціальному тиску p0, ось чому тиск на катоді дорівнює нулю.
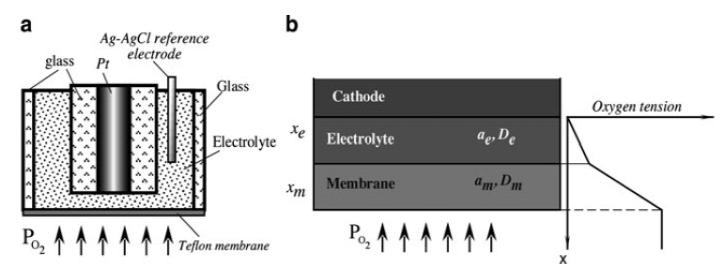
Рис. 6. Електрод Кларка (a) і одномірна модель першого порядку (b) розподілу тиску кисню по всій системі (запозичене зі статті [32]).
Можна показати, що стаціонарний струм електрода задається
І ≈ 4FamDmp0/xm , (8)
де А - площа електрода, аm - розчинність кисню в мембрані, F - постійна Фарадея, Dm є константою дифузії і хm є товщиною мембрани. Слід зазначити, що струм не залежить від товщини електроліту і властивостей дифузії. Мембрана з Teflon® використовується як киснево-проникна плівка. Ми можемо визначити чутливість датчика як відношення струму до парціального тиску кисню:
S = I/p0. (9)
Наприклад, якщо товщина мембрани 25 мкм, а площа катода дорівнює 2×10-6 см2 тоді чутливість дорівнює ~ 10-12 А/мм рт. ст.
Для ензімного амперометричного типу датчика може бути створений датчик, здатний вимірювати відносну нестачу кисню, викликану ферментною реакцією при використанні двох електродного датчика кисню Кларка. Принцип роботи датчика показаний на Рис. 7. Датчик складається з двох однакових електродів кисню, де один (А) покритий активним шаром окислювача, а інший (B) неактивним шаром ферменту.
Прикладом застосування є сенсор глюкози, де придушення активності може бути здійснено або хімічним, термічним шляхом або опроміненням. Датчик розміщений в пластиковій оболонці зі скляними коаксіальними трубками для підтримки двох Pt катодів і одного Ag анода. У відсутності ферментної реакції, потік кисню до цих електродів, і, отже, дифузійно-граничні струми приблизно рівні один одному. Коли глюкоза присутня в розчині і відбувається ферментативна реакція, кількість кисню досягає поверхні активного електрода і зменшується на величину, споживану ферментативною реакцією, що призводить до дисбалансу струму.
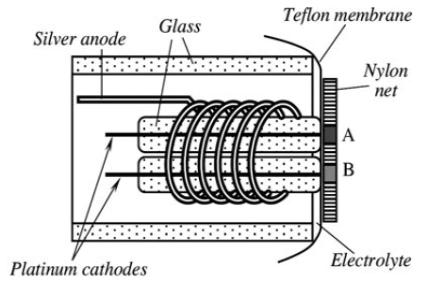
Рис . 7 . Спрощена схема амперометричного кисневого датчика Кларка адаптованого для виявлення глюкози.
