
- •Матеріальний баланс процесу згорання. Об'єми повітря і продуктів згорання
- •Побудова діаграми «ентальпія – температура» продуктів згоряння
- •Попередній тепловий баланс допоміжного котла
- •2,5 % Або знаходять по емпіричній залежності:
- •Розрахунок теплообміну в топці
- •Подготовка котла к действию
- •Обслуживание котла в действии
- •Вывод котла из действия
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХЕРСОНСЬКА ДЕРЖАВНА МОРСЬКА АКАДЕМІЯ
Факультет суднової енергетики
Кафедра експлуатації суднових енергетичних установок
та загальноінженерної підготовки
Курсова робота з дисципліни “Cудновi котельнi установки”
професійне спрямування “Експлуатація суднових енергетичних установок”
Виконав курсант групи 241 Боєчко Олексiй Олегович
Перевiрив старший викладач Скрипка Г.Л.
Матеріальний баланс процесу згорання. Об'єми повітря і продуктів згорання
Паливо нафтового походження складається з наступних хімічних елементів (вміст приведений в долях від одиниці):
- вуглець (С) – 0,84 – 0,87;
- водень (Н) – 0,10 – 0, 13;
- горюча сірка (S) – 0 – 0,04;
- кисень (О) – 0,003 – 0,005;
- азот N – 0,001 – 0,004.
Окрім них в паливі є волога W і зола А, які не беруть участь в горінні і утворюють так званий баласт.
Хімічний склад палива, що надходить в топку котла, характеризується робочою масою:
![]()
Розрахунок коефiцiенту перерахунку k
k= 1-AP-WP = 1-0,002-0,015 =0,983
Вмiст елементiв у робочiй массi палива:
Вуглець СP ; Cгk = 0,853*0,983 = 0,838
Водень HP = 0,1199
Сiрка SP= 0,00786
Кисень OP=0,0295
Азот NP= 0,001966
Приведений вуглець – KP= CP + 0,368 SP= 0,8409
Найважливішою характеристикою палива, використовуваною в теплових розрахунках, є його нижча робоча теплота згорання Qpн , кДж/кг, яка визначається без врахування тепла конденсації водяної пари, що утворюється в процесі горіння. Величину можна визначити по формулі, запропонованій Д. І. Мендєлєєвим:
![]()
QPH = 41123,1 кДж\кг
Теоретично необхідний об'єм повітря для повного згорання 1 кг палива з урахуванням того, що кисню в атмосферному повітрі міститься 21 % за об'ємом, а його щільність за нормальних умов (НУ) ρо складає 1,44 кг/м3, рівний, м3/кг:
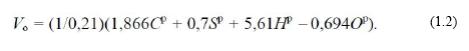
Vo = 10,262
Дійсний об'єм вологого повітря, м3/кг, що надходить в топку котла, для забезпечення повного згорання палива, рівний:
![]()
Vвл=1,15 *10,262(1+0,00161*8)= 11,953
Об'єм трьохатомних газів VR2O, м3/кг, відповідно до рівнянь окислення компонентів палива визначиться як:
![]()
VRO2 = 1,5615
Об'єм кисню VO2., м3/кг, невикористаного на окислення при горінні з α > 1, складає:
![]()
VO2 = 0,323
Об'єм азоту VN2 м3/кг, складається із азоту, що надходить з повітрям, в якому його за об'ємом міститься 79 %, і азоту палива. Сумарний об'єм азоту рівний:
![]()
VN2 = 9,3246
Повний об'єм водяної пари в продуктах згорання 1 кг палива, м3/кг:
![]()
VH20 = 1,5377
Об'єм сухих газiв , м3/кг: VСГ= VRO2 + VO2 +VN2
VСГ= 11,2091
Повний об'єм газоподібних продуктів згорання, що виходять з котла м3/кг:
![]()
VПС= 12,747
Об'ємна частина трьохатомних газiв : rRO2 = VRO2 / VПС
rRO2 = 0,1225
Об'ємна частина водяної пари : rH2O = VH20 / VПС
rH2O = 0,12063
Сумарна об'ємна частка газiв та пари : rП = rRO2 + rH2O
rП = 0,24313
Парцiональний тиск трьохатомных газiв , МПа: PR02 = Pт * rRO2
Тиск газів в топці Рт приймається рівним 0,101 МПа.
PR02 = 0.01237
Парцiональний тиск водяної пари, МПа: PH02 = Pт * rHO2
PH02 = 0,01218
Сумарний тиск : PП = PR02 + PH02
PП = 0,02455
Щiльнiсть
димових газiв
за нормальних умов (НУ) , кг/м3
: ρГО
=![]()
ρГО = 1,2862
Побудова діаграми «ентальпія – температура» продуктів згоряння
Після визначення об'єму продуктів згорання приступають до побудови діаграми І – t, основи для теплового розрахунку котла.
Ентальпія – кількість тепла, витрачена на нагрівання об'єму газів від 0 до t °С. Величину ентальпії відносять до об'єму газів, отриманих в результаті повного згорання 1 кг палива. Її виражають розмірністю [кДж/кг]. Ентальпія продуктів згорання, що є сумішшю різних газів, визначається як сума добутків теплоємностей окремих складових на їх об'єми
і температуру суміші. Таким чином ентальпія дійсного об'єму продуктів згорання одного кілограма палива, що згорає з коефіцієнтом надлишку повітря α > 1, рівна, кДж/кг:
![]()
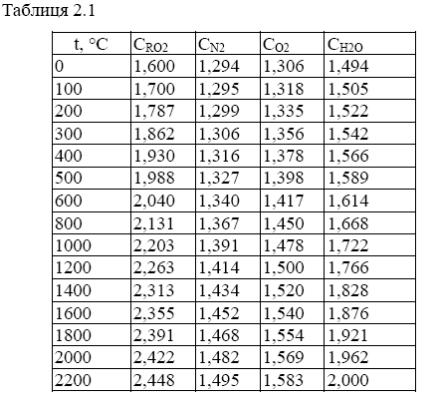
де СRO2, CN2, CH2O, CO2.– середні об'ємні ізобарні теплоємності відповідних газів, кДж/(м3 °С).
Ентальпія продуктів згорання палива одного і того ж складу залежить від значення коефіцієнта надлишку повітря α. З його зростанням збільшується об'єм газів, що виходять з котла. Тому для палива одного і того ж складу можна побудувати сімейство кривих
I = f(t) – кожна з яких відповідатиме різним значенням α.
Ентальпія продуктів згорання розраховується по формулі (2.1) в інтервалі температур 0 – 2200°С з кроком Δt рівним 100 – 200 °С. Величини середніх об'ємних ізобарних теплоємкостей газів, що складають продукти згорання. кДж/(м3 °С), для різних температур вказані в таблиці 2.1.
Початкові дані:
- об'єм трьохатомних газів VRO2, м3/кг;
- об'єм азоту VN2, м3/кг;
- об'єм вільного кисню VO2, м3/кг;
- об'єм водяної пари VH2O, м3/кг.
Розрахунок ентальпії газів і побудову діаграми зручно виконувати у формі таблиці. У першій колонці таблиці вказано поточне значення температури продуктів згорання, в наступних – величини добутків об'ємів газів, що становлять продукти згорання, на їх теплоємності і поточну температуру. У шостій колонці приведена їх сума, що є шуканою ентальпією. Сьома колонка таблиці містить значення ентальпії в масштабі і введена з метою спрощення побудови діаграми. Масштаб діаграми m приймається рівним
250 кДж/(кг мм).
t °С |
VRO2C RO2 t |
VN2C N2 t |
VO2C O2 t |
VH2OCH2O t |
I кДж/кг |
Мм |
100 |
265,45 |
1207,5 |
42,57 |
231,4 |
1746,9 |
7 |
200 |
558,08 |
2422,5 |
86,24 |
468,1 |
3534,9 |
14 |
300 |
872,25 |
3653,37 |
131,4 |
711,3 |
5368,3 |
21,5 |
400 |
1205,47 |
4908,47 |
178 |
963,2 |
7255,1 |
29 |
500 |
1552,12 |
6186,9 |
225,78 |
1221,7 |
9186,5 |
36,75 |
600 |
1911,28 |
7497 |
274,6 |
1489,1 |
11172 |
44,7 |
800 |
2662,04 |
10197,4 |
374,7 |
2052 |
15286,1 |
61 |
1000 |
3439,98 |
12970,5 |
477,4 |
2648 |
19535,9 |
78 |
1200 |
4240,4 |
15821,98 |
581,4 |
3258,7 |
23902 |
95,6 |
1400 |
5056,45 |
18420,1 |
687,3 |
3922,4 |
28386,25 |
113,5 |
1600 |
5883,73 |
21662,9 |
795,9 |
4615,65 |
32958,1 |
131,8 |
1800 |
6720,4 |
24639,3 |
903,5 |
5317 |
37580,2 |
150,3 |
2000 |
7563,9 |
27638,1 |
1013,57 |
6034 |
42249,5 |
169 |
2200 |
8409,6 |
30668,6 |
1124 |
6765,9 |
46969 |
188 |
