
- •37.Гликогенолиз. Общая характеристика, этапы, химизм, эенргетический эффект. Судьба лактата в организме. Глюкозолактатный цикл (цикл Кори).
- •43. Переваривание углеводов в желудочно-кишечном тракте. Всасывание продуктов переваривания. Роль целлюлозы в питании человека.
- •44.Глюкоза - важнейший метаболит углеводного обмена: схема путей поступления и использования глюкозы крови. Уровень глюкозы в крови и его регуляция. Гипо- и гипергликемия. Виды и причины.
- •45. Синтез и распад гликогена. Особенности обмена гликогена в печени и мышцах. Наследственные нарушения обмена гликогена.
- •62)Общие липиды крови. Транспорт липидов крови. Липопротеиды. Классификация, состав (Хиломикроны, лпонп, лпнп, лпвп). Структура, биологическая роль, метаболизм.
- •64).Внутриклеточное окисление глицерола: химизм процесса, энергетический эффект. Конечные метаболиты. Общность путей окисления углеводов и липидов.
- •65.Внутриклеточное окисление жирных кислот. Локализация пр-са в клетке: поступление в митохондриальный матрикс (3-х этапное предварительное ферментативное превращение жиров).
- •66.Внутриклеточное окисление жирных к-т. Две фазы окисления. Первая фаза- бета окисление (сущность пр-са, химизм р-ий, хар-ка ферментных систем, энергетический эффект)
- •71)Биосинтез и катаболизм кетоновых тел. Биологическая роль кетоновых тел. Кетоз. Виды и причины.
- •72)Патология липидного обмена. Нарушение переваривания и всасывания липидов. Причины и последствия (гиповитаминозы, стеаторея). Ожирение. Липотропные факторы как лекарственные средства.
- •73)Биохимия атеросклероза и лекарственные препараты, применяемые для его лечения.
45. Синтез и распад гликогена. Особенности обмена гликогена в печени и мышцах. Наследственные нарушения обмена гликогена.
Гликоген синтезируется в период пищеварения
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми ↔ дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции:УДФ-глюкопирофосфорилаза.
О бразованная УДФ-глюкоза далее
используется как донор остатка глюкозы
при синтезе гликогена (реакция 4). Эту
реакцию катализирует фермент гликогенсинтаза
(глюкозилтрансфераза).гликоген
в клетке никогда не расщепляется
полностью, синтез гликогена осуществляется
путём удлинения уже имеющейся молекулы
полисахарида, называемой "праймер
- последовательно
присоединяются молекулы глюкозы.
бразованная УДФ-глюкоза далее
используется как донор остатка глюкозы
при синтезе гликогена (реакция 4). Эту
реакцию катализирует фермент гликогенсинтаза
(глюкозилтрансфераза).гликоген
в клетке никогда не расщепляется
полностью, синтез гликогена осуществляется
путём удлинения уже имеющейся молекулы
полисахарида, называемой "праймер
- последовательно
присоединяются молекулы глюкозы.
Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления".по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде.
В. Распад гликогена (гликогенолиз)
происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой.
Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахариднойцепи.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера.
Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой.
Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат.
4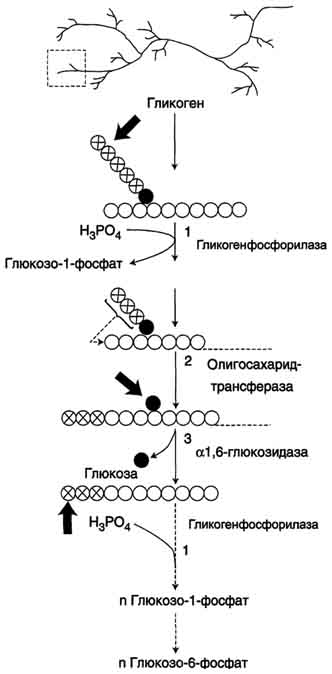 6.
Гликолиз. Общая характеристика процесса.
Химизм и характеристика этапов гликолиза.
Судьба восстановленного кофактора
НАДН∙Н+,
образовавшегося на стадии окисления
3-ФГА. Ключевые ферменты гликолиза
(гексокиназа, фосфофруктокиназа,
пируваткиназа). Аллостерическая регуляция
гликолиза.
6.
Гликолиз. Общая характеристика процесса.
Химизм и характеристика этапов гликолиза.
Судьба восстановленного кофактора
НАДН∙Н+,
образовавшегося на стадии окисления
3-ФГА. Ключевые ферменты гликолиза
(гексокиназа, фосфофруктокиназа,
пируваткиназа). Аллостерическая регуляция
гликолиза.
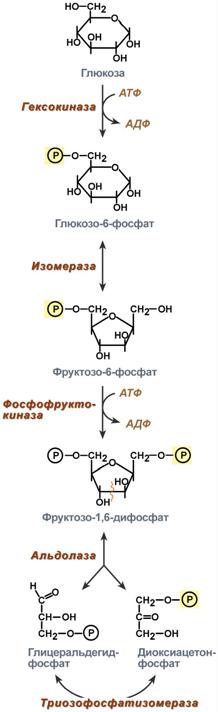
Гликолиз — это сложный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз,протекающий без потребления кислорода).
Суммарное уравнение анаэробного гликолиза:
C6H12O6 + 2АДФ + 2Фн®2CH3CH(OH)COOH + 2АТФ + 2H2O
Гликолиз функционирует во всех живых клетках. Все ферменты локализованы в цитозоле, формируя полиферментный комплекс.
Гликолиз осуществляется в два этапа.
Подготовительный этап — дихотомический распад глюкозы на две молекулы глицеральдегид-3-фосфата. Превращения сопровождаются затратой 2 АТФ.
Этап гликолитической оксидоредукции — превращение глицеральдегид-3-фосфата в лактат. Включает окислительно-восстановительные реакции и реакции фосфорилирования,сопровождающиеся генерацией АТФ. На втором этапе окисляются две молекулы глицеральдегид-3-фосфата, поэтому в реакциях впереди формулы субстрата следует ставить коэффициент 2.
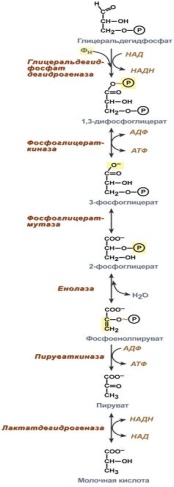
В анаэробных условиях окисление НАДН.Н+, восстановленного в глицеральдегидфосфатдегидрогеназной реакции, происходит в лактатдегидрогеназной реакции. В аэробных условиях НАДН.Н+ окисляется кислородом с участием ферментов дыхательной цепи, а выделяющаяся при этом энергия используется на синтез 1,5 или 2,5 моль АТФ (в зависимости от челночного механизма транспорта гликолитического НАДН.Н+ в
митохондрию). Энергетический баланс гликолиза — две молекулы АТФ на одну молекулу глюкозы. На I этапе гликолиза расходуются две молекулы АТФ для активирования субстрата (в гексокиназной и фосфофруктокиназной реакциях). На II этапе образуются четыре молекулы АТФ (в фосфоглицераткиназной и пируваткиназной реакциях). Синтез АТФ осуществляется путем субстратного фосфорилирования.
Ключевые ферменты гликолиза:
1. Гексокиназа — это регуляторный фермент гликолиза во внепеченочных клетках. Гексокиназа аллостерически ингибируется глюкозо-6-фосфатом. Глюкокиназа — регуляторный фермент гликолиза в гепатоцитах. Синтез глюкокиназы индуцируется инсулином.
2. Фосфофруктокиназа-1. Это главный ключевой фермент, катализирует реакцию, лимитирующую скорость всего процесса (наиболее медленная реакция). Синтез фермента индуцируется инсулином. Аллостерические активаторы — АМФ, АДФ, фруктозо-2,6- дифосфат. Уровень фруктозо-2,6-дифосфата увеличивается под действием инсулина и понижается под действием глюкагона. Аллостерические ингибиторы — АТФ, цитрат.
3. Пируваткиназа. Фермент активен в нефосфорилированной форме. Глюкагон (в гепатоцитах) и адреналин (в миоцитах) стимулируют фосфорилирование фермента, а значит инактивируют фермент. Инсулин, наоборот, стимулирует дефосфорилирование фермента, а значит активирует фермент. Аллостерический активатор — Фр-1,6-ФФ. Аллостерический ингибитор — АТФ, ацетил~КоА. Синтез фермента индуцирует инсулин.
49.Аэробное окисление глюкозы. Общность путей аэробного и анаэробного окисления. Пируват – общий ключевой метаболит. Энергетический эффект аэробного окисления глюкозы. Челночные механизмы переноса водорода из цитозоля в митохондрии: малат-аспартатный и глицерофосфатный (в виде схемы).
Катаболизм глюкозы - основной поставщик энергии для процессов жизнедеятельности организма.
Основные пути катаболизма глюкозы
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Этот процесс включает несколько стадий (рис. 7-33).
Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата;
Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
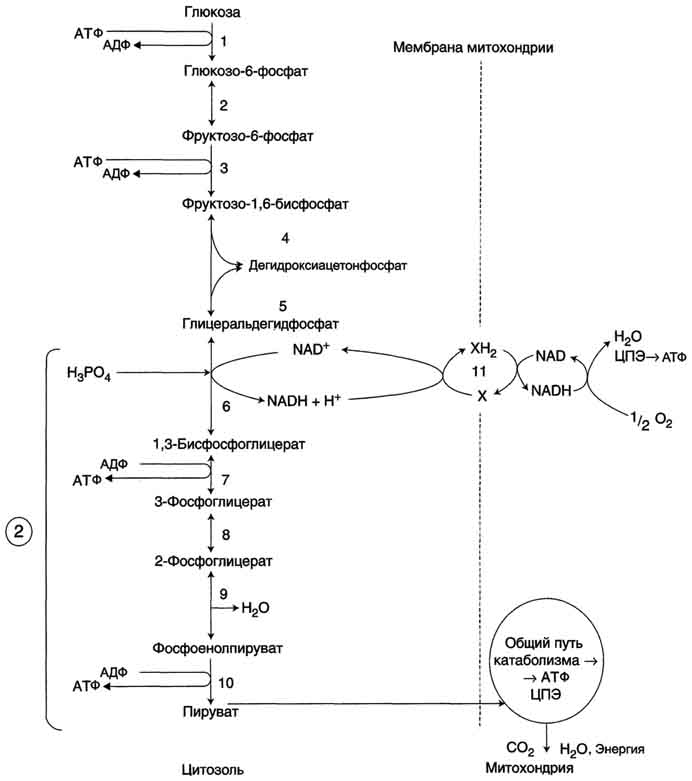
Аэробный распад глюкозы. 1-10- реакции аэробного гликолиза; 11 - малат-аспартатный челночный механизм транспорта водорода в митохондрии; 2 (в кружке) - стехиометрический коэффициент.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Глицерофосфатная челночная система. 1 - глицеральдегид-3-фосфатдегидрогеназа; 2 - глицерол-3-фосфатдегидрогеназа (цитозольный фермент, назван по обратной реакции); 3 - глицерол-3-фосфатдегидрогеназа (митохондриальныи флавиновый фермент).

Малат-аспартатная челночная система. 1,2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на ЦПЭ; 3,4 - транслоказы, обеспечивающие транспорт а-кетоглутарата, аспартата и глутамата и через мембрану митохондрий.
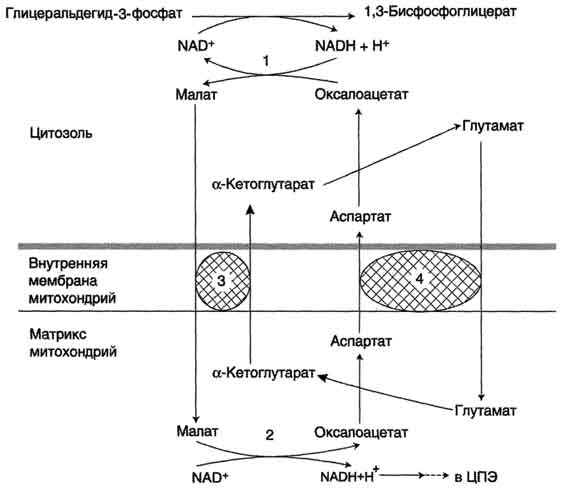
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ.
Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей.
50.Понятие о пентозофосфатном пути окисления глюкозы (общая характеристика). Окислительная стадия пентозофосфатного окисления глюкозы (до образования рибулозо-5-фосфата). Биологическое значение пентозофосфатного окисления глюкозы.
Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH.
В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах.
Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты локализованы в цитозоле.
Окислительный этап
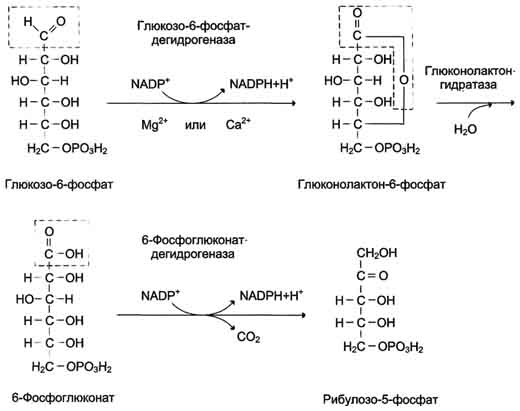
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется МАDР+-зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH.
Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы.
Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH
Суммарное уравнение окислительного этапа пентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного этапа служат основным источником NADPH в клетках.
Пентозофосфатный путь является альтернативным путем окисления глюкозы. Он включает несколько циклов, в результате функционирования которых из трех молекулглюкозо-6-фосфат а образуются три молекулы CO2 и три молекулы пентоз . Последние используются для регенерации двух молекул глюкозо-6-фосфата и одной молекулы глицеральдегид-3-фосфат а
он выполняет две главные функции:
1) обpазование NADPH для восстановительных синтезов, таких как синтез жиpных кислот и стеpоидов;
2) обеспечение pибозой синтеза нуклеотидов и нуклеиновых кислот.
Липиды, физиологическая роль, потребность в липидах. Переваривание и всасывание липидов. Условия, необходимые для переваривания и всасывания липидов в желудочно-кишечном тракте. Ресинтез ТАГ в стенке кишечника. Биологическая роль.
Липи́ды — широкая группа органических соединений, включающая жирные кислоты, а также их производные, как по радикалу, так и по карбоксильной группе.
Молекулы простых липидов состоят из спирта, жирных кислот, сложных — из спирта, высокомолекулярных жирных кислот, возможны остатки фосфорной кислоты, углеводов, азотистых оснований и др. Строение липидов зависит в первую очередь от пути их биосинтеза.
Биологические функции
Энергетическая (резервная) функция
Многие жиры, в первую очередь триглицериды, используются организмом как источник энергии. При полном окислении 1 г жира выделяется около 9 ккал энергии, примерно вдвое больше, чем при окислении 1 г углеводов (4.1 ккал). Жировые отложения используются в качестве запасных источников питательных веществ, прежде всего животными, которые вынуждены носить свои запасы на себе. Растения чаще запасают углеводы, однако в семенах многих растений высоко содержание жиров (растительные масла добывают из семян подсолнечника, кукурузы, рапса, льна и других масличных растений).
Функция теплоизоляции
Жир — хороший теплоизолятор, поэтому у многих теплокровных животных он откладывается в подкожной жировой ткани, уменьшая потери тепла. Особенно толстый подкожный жировой слой характерен для водных млекопитающих (китов, моржей и др.). Но в то же же время у животных, обитающих в условиях жаркого климата (верблюды, тушканчики) жировые запасы откладываются на изолированных участках тела (в горбах у верблюда, в хвосте у жирнохвостых тушканчиков), в качестве резервных запасов воды, так как вода — один из продуктов окисления жиров.
Структурная функция
Фосфолипиды составляют основу биослоя клеточных мембран, холестерин — регулятор текучести мембран. У архей в состав мембран входят производные изопреноидных углеводородов. Воскиобразуют кутикулу на поверхности надземных органов (листьев и молодых побегов) растений. Их также производят многие насекомые (так, пчёлы строят из них соты, а червецы и щитовки образуют защитные чехлы).
Регуляторная
Витамины — липиды (A, D, E, K)
Гормональная (стероиды, эйкозаноиды, простагландины и прочие.)
Кофакторы (долихол)
Сигнальные молекулы (диглицериды, жасмоновая кислота; МP3-каскад)
Защитная (амортизационная)
Толстый слой жира защищает внутренние органы многих животных от повреждений при ударах (например, сивучи при массе до тонны могут прыгать на каменистый берег со скал высотой 4-5 м).
Увеличения плавучести
Самые разные организмы — от диатомовых водорослей до акул — используют резервные запасы жира как средство снижения среднего удельного веса тела и, таким образом, увеличения плавучести. Это позволяет снизить расходы энергии на удержание в толще воды.
Суточная потребность взрослого человека в липидах — 70—140 граммов.
Ж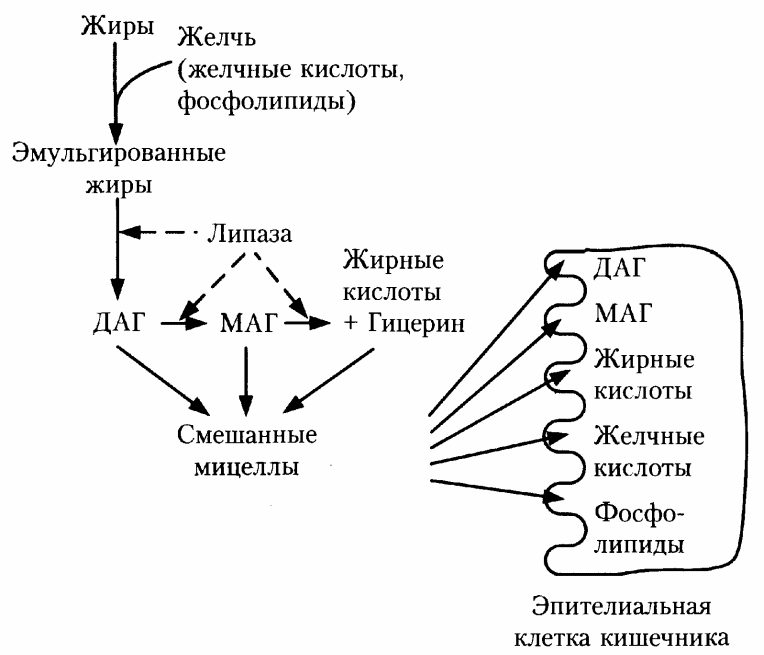 иры,
наряду с белками и углеводами, относятся
к основным пищевым веществам человека.
Суточная потребность в них составляет
50-100 г. Жиры обеспечивают до 50 % потребности
организма в энергии. Переваривание
жиров происходит в тонком кишечнике.
В двенадцатиперстную кишку поступает
желчь и сок поджелудочной железы,
необходимые для переваривания жиров.
В соке поджелудочной железы содержится
липаза, гидролизую- щая сложноэфирную
связь в триацилглицеринах. Под действием
липазы жирные кислоты отщепляются от
триацилглицерина одна за другой, сначала
от а-углерод- ных атомов, потом от
в-углеродного атома
иры,
наряду с белками и углеводами, относятся
к основным пищевым веществам человека.
Суточная потребность в них составляет
50-100 г. Жиры обеспечивают до 50 % потребности
организма в энергии. Переваривание
жиров происходит в тонком кишечнике.
В двенадцатиперстную кишку поступает
желчь и сок поджелудочной железы,
необходимые для переваривания жиров.
В соке поджелудочной железы содержится
липаза, гидролизую- щая сложноэфирную
связь в триацилглицеринах. Под действием
липазы жирные кислоты отщепляются от
триацилглицерина одна за другой, сначала
от а-углерод- ных атомов, потом от
в-углеродного атома
В составе желчи содержатся конъюгированные желчные кислоты, фосфолипиды и холестерин.
Желчные кислоты и фосфолипиды обладают амфифильными свойствами. На поверхности раздела жир/вода они ориентируются таким образом, что гидрофобная часть контактирует с жиром, а гидрофильная — с водной фазой, в результате чего образуются стабильные мицеллы. Липаза адсорбируется на поверхности мицелл, где и происходит гидролиз жира (рис. 10.13). Продукты переваривания жиров вместе с желчными кислотами и фосфолипидами желчи образуют смешанные мицеллы, и затем все компоненты мицелл проникают в клетки слизистой кишечника.
Желчные кислоты затем поступают в кровь, а с ней — в печень и повторно участвуют в образовании желчи.
П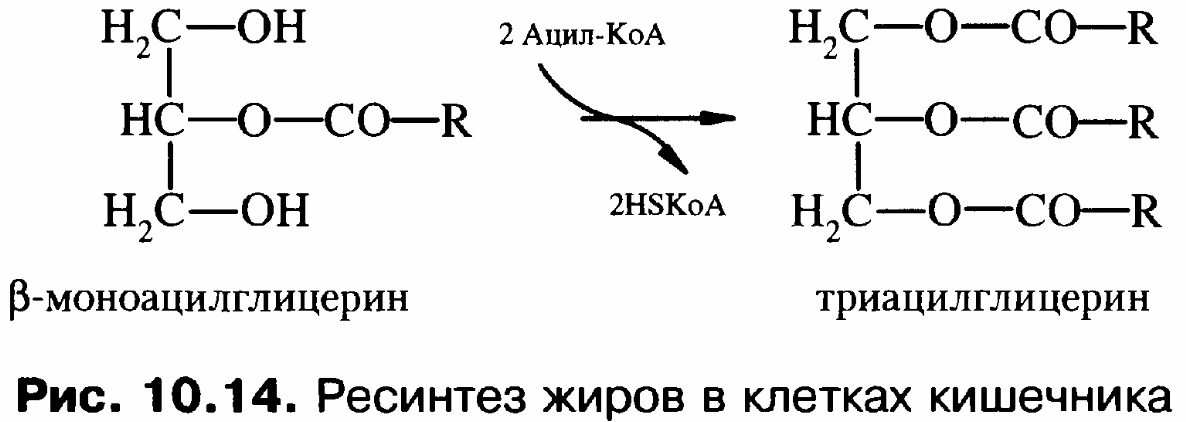 ри
нарушении желчеобразования или выделения
желчи условия переваривания жиров и
всасывания продуктов гидролиза
ухудшаются, и значительная их часть
выводится с калом (стеаторея).
Жирорастворимые витамины при этом
также не всасываются, что приводит к
развитию гиповитаминоза. В клетках
кишечника большая часть продуктов
переваривания вновь превращается в
триацилглицерины. Жирные кислоты
образуют ацил-КоА, а затем ацильные
остатки переносятся на моноацилглицерин
при участии трансацилаз.
ри
нарушении желчеобразования или выделения
желчи условия переваривания жиров и
всасывания продуктов гидролиза
ухудшаются, и значительная их часть
выводится с калом (стеаторея).
Жирорастворимые витамины при этом
также не всасываются, что приводит к
развитию гиповитаминоза. В клетках
кишечника большая часть продуктов
переваривания вновь превращается в
триацилглицерины. Жирные кислоты
образуют ацил-КоА, а затем ацильные
остатки переносятся на моноацилглицерин
при участии трансацилаз.
Химический состав желчи: печеночная и пузырная желчь. Желчные кислоты: первичные и вторичные. Конъюгированные желчные кислоты и их роль в переваривании и всасывании продуктов гидролитического расщепления липидов
Печеночная желчь имеет золотисто-желтый цвет, пузырная - темно-коричневый; рН печеночной желчи - 7,3-8,0, относительная плотность - 1,008-1,015; рН пузырной желчи - 6.0-7,0 за счет всасывания гидрокарбонатов, а относительная плотность - 1,026-1,048.
Желчь состоит из 98% воды и 2% сухого остатка, куда входят органические вещества: соли желчных кислот, желчные пигменты - билирубин и биливердин, холестерин, жирные кислоты, лецитин, муцин, мочевина, мочевая кислота, витамины А, В, С; незначительное количество ферментов: амилаза, фосфатаза, протеаза, каталаза, оксидаза, а также аминокислоты и глюкокортикоиды; неорганические вещества: Nа+, К+, Са2+, Fe++, С1-, HCO3-, SO4-, Р04-. В желчном пузыре концентрация всех этих веществ в 5-6 раз больше, чем в печеночной желчи.
Холестерин - 80% его образуется в печени, 10% - в тонком кишечнике, остальное - в коже. За сутки синтезируется около 1 г холестерина. Он принимает участие в образовании мицелл и хиломикронов и только 30% всасывается из кишечника в кровь. Если нарушается выведение холестерина (при заболевании печени или неправильной диете), то возникает гиперхолестеринемия, которая проявляется или в виде атеросклероза, или желчнокаменной болезни.
Желчные кислоты синтезируются из холестерина. Взаимодействуя с аминокислотами глицином и таурином, образуют соли гликохолевой (80%) и таурохолевой кислот (20%). Они способствуют эмульгированию и лучшему всасыванию в кровь жирных кислот и жирорастворимых витаминов (A, D, Е, К). За счет гидрофильности и липофильности жирные кислоты способны образовывать мицеллы с жирными кислотами и эмульгировать последние.
Желчные пигменты - билирубин и биливердин придают желчи специфическую желто-коричневую окраску. В печени, селезенке и костном мозге происходит разрушение эритроцитов и гемоглобина. Вначале из распавшегося гема образуется биливердин, а затем билирубин. Далее вместе с белком в нерастворенной в воде форме билирубин с кровью транспортируется в печень.
Там, соединившись с глюкуроновой и серной кислотами, он образует водорастворимые конъюгаты, которые выделяются печеночными клетками в желчный проток и в двенадцатиперстную кишку, где от конъюгата под действием микрофлоры кишечника отщепляется глюкуроновая кислота и образуется стеркобилин, придающий калу соответствующую окраску, а после всасывания из кишечника в кровь, а затем в мочу - уробилин, окрашивающий мочу в желтый цвет.
При поражении клеток печени, например, при инфекционном гепатите или закупорке желчных протоков камнями или опухолью, в крови накапливаются желчные пигменты, появляется желтая окраска склер и кожи. В норме содержание билирубина в крови составляет 0,2-1,2 мг%, или 3,5- 19 мкмоль/л (если больше 2-3 мг%, возникает желтуха).
Первичные желчные кислоты - холевая кислота и хенодезоксихолевая кислота - синтезируются в печени из холестерина , конъюгируются с глицином или таурином и секретируются в составе желчи . Вторичные желчные кислоты , включая дезоксихолевую кислоту и литохолевую кислоту , образуются из первичных желчных кислот в толстой кишке под действием бактерий. Литохолевая кислота всасывается значительно хуже, чем дезоксихолевая . Другие вторичные желчные кислоты образуются в ничтожно малых количествах. К ним относятся урсодезоксихолевая кислота (стереоизомер хенодезоксихолевой кислоты ) и ряд других необычных желчных кислот. При хроническом холестазе эти кислоты обнаруживаются в повышенных количествах. В норме соотношение количеств желчных кислот, конъюгированных с глицином и таурином , составляет 3:1; при холестазе часто повышены концентрации желчных кислот, конъюгированных с серной и глюкуроновой кислотами .
Жиры составляют до 90% липидов, поступающих с пищей. Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием "липазы языка". Этот фермент синтезируется железами на дорсальной поверхности языка и относительно устойчив при кислых значениях рН желудочного сока. Поэтому он действует в течение 1-2 ч на жиры пищи в желудке. Основной процесс переваривания происходит в тонкой кишке. Жёлчные кислоты представляют собой в основном конъюгированные жёлчные кислоты: таурохолевую, гликохолевую и другие.После приёма жирной пищи жёлчный пузырь сокращается и жёлчь изливается в просвет двенадцатиперстной кишки.
Переваривание жиров - гидролиз жиров панкреатической липазой. Оптимальное значение рН для панкреатической липазы ≈8 достигается путём нейтрализации кислого содержимого, поступающего из желудка, бикарбонатом, выделяющимся в составе сока поджелудочной железы:
Н+ + НСО3- → Н2СО3 → Н2О + СО2 ↑.
Выделяющийся углекислый газ способствует дополнительному перемешиванию содержимого тонкой кишки.
Панкреатическая липаза выделяется в полость тонкой кишки из поджелудочной железы вместе с белком колипазой. Колипаза попадает в полость кишечника в неактивном виде и частичным протеолизом под действием трипсина превращается в активную форму. Колипаза своим гидрофобным доменом связывается с поверхностью мицеллы эмульгированного жира. Другая часть молекулы способствует формированию такой конформации панкреатической липазы, при которой активный центр фермента максимально приближен к своим субстратам - молекулам жиров , поэтому скорость реакции гидролиза жира резко возрастает.
