- •Лекція 8
- •План лекції
- •Зміст лекції:
- •Типи розчинів, способи вираження концентрацій: відсоткова, молярна, нормальна, титр. Перехід від однієї форми вираження концентрації до іншої.
- •2. Теорія електролітичної дисоціації. Ступінь і константа дисоціації. Сильні і слабкі електроліти.
- •Основні положення теорії електролітичної дисоціації
- •3. Дисоціація амфотерних електролітів. Активність і іонна сила розчинів.
- •1. Голубєв а.В., Лисін в.І., Коваленко, Тарасенко г.В, Хімія. - к.: Кондор, 2013 стр. 176-181.
- •2. Цвєткова л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 6.1-6.9;
- •3. Романова н.В. Загальна та неорганічна хімія. - к.:Ірпінь, 2004 § 8.1-8.3; 9.1.
3. Дисоціація амфотерних електролітів. Активність і іонна сила розчинів.
До амфотерних електролітів відносяться амфотерні гідроксиди, які проявляють металічні та неметалічні властивості.
Існують гідроксиди, здатні вступати у взаємодію і утворювати солі не тільки з кислотами, але і з основами. До таких гідроксиду належить гідроксид цинку. При взаємодії його, наприклад, з соляною кислотою виходить хлорид цинку:
Zn(OH)2 + 2НСl = ZnСl2 + 2Н2О
а при взаємодії з гідроксидом натрію - цинкат натрію:
Zn(OH)2 + 2NaOH = Na2ZnО2 + 2Н2О
Гідроксиди, які володіють цією властивістю, називаються амфотерними гідроксидами або амфотерними електролітами. До таких гідроксиду, крім гідроксиду цинку, відносяться гідроксиди алюмінію, хрому і деякі інші.
Явище амфотерності пояснюється тим, що в молекулах амфотерних електролітів міцність зв'язку між металом і киснем незначно відрізняється від міцності зв'язку між киснем і воднем. Дисоціація таких молекул можлива, отже, по місцях обох цих зв'язків. Ме -----О-------Н
Якщо позначити амфотерний електроліт формулою ROH, то його дисоціацію можна виразити схемою
Н + + RO - ↔ ROH ↔ R + + OH –
Таким чином, у розчині амфотерного електроліту існує складна рівновага, в якому беруть участь продукти дисоціації як за типом кислоти, так і за типом основи.
Явище амфотерності спостерігається також серед деяких органічних сполук. Важливу роль воно відіграє у біологічної хімії; наприклад, білки - амфотерні електроліти.
У розчинах сильних електролітів концентрація іонів досить велика, тому що сили між іонних взаємодії помітно проявляються навіть при малій концентрації електроліту. В результаті іони виявляються не цілком вільними у своєму русі, і всі властивості електроліту, що залежать від числа іонів, виявляються слабкіше, ніж варто було б очікувати при повній дисоціації електроліту на що не взаємодіють між собою іони. Тому для опису стану іонів в розчині користуються, поряд з концентрацією іонів, їх активністю, тобто умовної (ефективної) концентрацією іонів, відповідно до якої вони діють в хімічних процесах. Активність іона а (моль / л) пов'язана з його молярної концентрацією в розчині С співвідношенням
a
= f*C
де f
-
коефіцієнт активності іона (безрозмірна
величина).
![]() Коефіцієнти
активності іонів залежать від складу
і концентрації розчину, від заряду і
природи лона і від інших умов. Однак у
розведених розчинах (С
≤ 0,5 моль / л) природа
іона слабо позначається на величині
його коефіцієнта активності. Наближено
можна вважати, що в розведених розчинах
коефіцієнт активності іона в даному
розчиннику залежить тільки від заряду
іона та іонної сили розчину I, яка дорівнює
напівсумі творів концентрації З
кожного іона на квадрат його заряду z:
I
= 0,5 (З
1
z
1
2
+ З
2
z
2
2
+ ... + С
n
z
n
2)
= 0,5 С
i
z
i
2
У табл.1 приведені значення коефіцієнтів
активності іонів у розведених розчинах
в залежності від їх заряду і іонної сили
розчину. Наближено коефіцієнт активності
іона в розведеному розчині можна також
обчислити за формулою: lg
f
= - 0,5 z
2
-
Коефіцієнти
активності іонів залежать від складу
і концентрації розчину, від заряду і
природи лона і від інших умов. Однак у
розведених розчинах (С
≤ 0,5 моль / л) природа
іона слабо позначається на величині
його коефіцієнта активності. Наближено
можна вважати, що в розведених розчинах
коефіцієнт активності іона в даному
розчиннику залежить тільки від заряду
іона та іонної сили розчину I, яка дорівнює
напівсумі творів концентрації З
кожного іона на квадрат його заряду z:
I
= 0,5 (З
1
z
1
2
+ З
2
z
2
2
+ ... + С
n
z
n
2)
= 0,5 С
i
z
i
2
У табл.1 приведені значення коефіцієнтів
активності іонів у розведених розчинах
в залежності від їх заряду і іонної сили
розчину. Наближено коефіцієнт активності
іона в розведеному розчині можна також
обчислити за формулою: lg
f
= - 0,5 z
2
-
![]() .
Таблиця
1.
.
Таблиця
1.
Іонна сила розчину I |
Заряд іона z |
||
± 1 |
± 2 |
± 3 |
|
0,001 0,002 0,005 0,01 0,02 0,05 0,1 0,2 0,3 |
0,98 0,97 0,95 0,92 0,90 0,84 0,81 0,80 0,81 |
0,78 0,74 0,66 0,60 0,53 0,50 0,44 0,41 0,42 |
0,73 0,66 0,55 0,47 0,37 0,21 0,16 0,14 |
Факт розкладання електролітів при проходженні через них струму показує, що в них рух зарядів супроводжується рухом атомів або груп атомів, пов'язаних один з одним (наприклад, SO 4, NO 3 і т.п.); ці атоми або атомні групи представляють собою частини молекули розчиненої речовини. Природно припустити, що заряджені саме ці частини молекули в розчині і що вони є носіями електричного заряду. Їх переміщення під дією сил електричного поля і являє собою електричний струм, що йде через електроліт. Було виявлено, що при проходженні струму через електроліт виділення речовини відбувається на обох електродах. За хімічним складом це різні частини молекули розчиненої речовини. За кількістю, якщо вимірювати його в хімічних еквівалентах, вони рівні. Знаки зарядів у них, очевидно, протилежні. Ми знаємо, що заряджені атоми називаються іонами. Те ж назву носять заряджені молекули або їх частини. Ми можемо, отже, сказати, що провідність електролітів є іонної, тобто обумовлена рухом у них позитивних і негативних іонів, які утворюються з нейтральної молекули шляхом розпаду її на дві частини, заряджені рівними і протилежними зарядами. Молекули розчиненої речовини, які до розчинення були електрично-нейтральні, при розчиненні розпадаються на позитивні і негативні іони, здатні переміщатися незалежно один від одного.
|
|
|
|
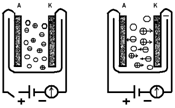
а) б) Рис.1. Провідність електроліту залежить від наявності позитивних і негативних іонів (кухлі зі знаками "+" або "-"): а) ланцюг розімкнена, струму немає, б) коло замкнуте, через електроліт йде іонний струм. Ці уявлення ілюструються рис.1. Гуртками між електродами зі значками "+" і "-" схематично зображені позитивні і негативні іони розчиненого речовини. Поки між електродами А і К не створено поле, іони ці роблять тільки безладне тепловий рух, як і всі інші молекули розчину (рис.1, а). У кожному напрямку за одиницю часу протікає однаковий позитивний і негативний заряд, тобто немає електричного струму - переважного переносу заряду в певному напрямку. При накладенні різниці потенціалів на електроди А і К, коли всередині електроліту виникає електричне поле, на це безладний рух накладається впорядкований рух в протилежні сторони іонів різних знаків: негативних - до анода А, позитивних - до катода К (рис.1, б). При зіткненні з катодом позитивні іони отримують відсутні їм електрони і виділяються у вигляді нейтральних атомів, а натомість електронів, нейтралізувати іони, нові електрони переходять від батареї до катода. Точно так само негативні іони при зіткненні з анодом віддають йому свої надлишкові електрони, перетворюючись в нейтральні атоми; електрони ж ідуть по металевим проводам в батарею. Таким чином, струм у електроліті обумовлений рухомими іонами; на електродах ж відбувається нейтралізація іонів і виділення їх у вигляді нейтральних атомів (або молекул). Отже, електричний струм в електролітах являє собою рух позитивних і негативних іонів.
Контрольні питання:
Що таке розчини і як їх класифікують?
Які способи вираження концентрацій існують?
Як можна перейти від однієї концентрації до іншої?
Назвіть основні положення теорії електролітичної дисоціації.
Як визначити силу електроліту?
Як дисоціюють амфотерні електроліти?
В чому заключається активність і йонна сила розчинів?
Домашнє завдання:
Опрацювати :
Література