
- •Лекція 6
- •Швидкість хімічних реакцій. Активні молекули і енергія активації.
- •2. Фактори, які впливають на швидкість реакції у гомогенній і гетерогенній системах. Правило Вант-Гоффа.
- •3. Константа швидкості реакції.
- •1. Голубєв а.В., Лисін в.І., Коваленко, Тарасенко г.В, Хімія. - к.: Кондор, 2013 стр. 136-143
- •2. Цвєткова л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 5.1-5.4;
- •3. Романова н.В. Загальна та неорганічна хімія. - к.:Ірпінь, 2004 § 6.1-6.5.
Лекція 6
Тема. Швидкість хімічної реакції, залежність її від різних чинників.
План лекції
1. Швидкість хімічних реакцій. Активні молекули і енергія активації.
2. Фактори, які впливають на швидкість реакції у гомогенній і гетерогенній системах. Правило Вант-Гоффа. Закон діючих мас.
3. Константа швидкості реакції
Література
1. Голубєв А.В., Лисін В.І., Коваленко, Тарасенко Г.В, Хімія. - К.: Кондор, 2013 стр. 136-143
2. Цвєткова Л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 5.1-5.4;
3. Романова Н.В. Загальна та неорганічна хімія. - К.:Ірпінь, 2004 § 6.1-6.5.
Зміст лекції:
Швидкість хімічних реакцій. Активні молекули і енергія активації.
Існує багато галузей де швидкість має провідну роль. Це органічний та неорганічний синтез речовин та їх сполук, швидкість горіння, корозії тощо. (слайд № 5)
Наука, яка вивчає перебіг хімічних процесів за певний час, називається хімічною кінетикою.
Багато вчених хіміків присвятило свій час на вивчення даної характеристики. Це такі вченні як Якоб Вант-Гофф який відкрив залежність швидкості від температури, Сванте Ареніус досліджував миттєві реакції при змінних температурах, Семенов, Петер та ін.(слайд №6)
Вивчення чинників, які впливають на швидкість процесів, визначення оптимальних умов, за яких можна здійснити реакцію добування заданої речовини, є предметом хімічної кінетики.
Швидкість хімічної реакції – визначається кількістю речовини, яка вступила у хімічну реакцію, або утворилася внаслідок неї за одиницю часу в одиниці об’єму реакційної суміші. (слайд №7)
v![]()
![]()
Швидкість хімічної реакції може проходити у двох варіантах:
у гомогенній системі;
у гетерогенній системі. Розглянемо специфіку на прикладі горіння.
Перший – коли горючий матеріал (відновник) і кисень повітря (окислювач) перебувають в одній фазі, в газовій (гомогенне горіння, система). І другий – коли відновник (горюча речовина) – твердий, а окислювач (кисень повітря) – газ (гетерогенне горіння, система).
Якщо реакція проходить у гомогенній системі, то вважається, що вона йде одночасно по всьому об’ємі. В гетерогенній ж системі реакція може проходити тільки на поверхні.
Звідси швидкістю гомогенної реакції називається кількість речовини, що вступає в реакцію, або речовини, що утворюється внаслідок реакції, за одиницю часу в одиниці об’єму системи.
Позначається υ, виражається моль/л*сек.
Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію, або речовини, що утворюється внаслідок реакції, за одиницю часу, на одиниці площі поверхні розділу фаз. Позначається υ, виражається моль/м2*сек. (слайд № 8).
Активні молекули і енергія активації
Хімічні перетворення відбуваються в разі зіткнення молекул, тобто в результаті зіткнення перебудовуються хімічні зв’язки, старі розриваються, а нові утворюються. Пригадаємо якщо енергії при розриві старого зв’язку більша, ніж потрібно на утворення то надлишкова енергія виділяється (екзотермічна), якщо менше – поглинається (ендотермічна).
Як зазначалося, умовою елементарного акту взаємодії є зіткнення реагуючих часток. Однак не кожне зіткнення може привести до хімічної взаємодії. Насправді, хімічна взаємодія передбачає перерозподіл електронної густини, утворення нових хімічних зв’язків і перегрупування атомів. Таким чином, крім зіткнення енергія реагуючих часток повинна бути більша за енергію відштовхування (енергетичний бар’єр) між їх електронними оболонками.
Швидкість реакції залежить не від числа загальних зіткнень, (оскільки не кожне зіткнення може призвести до взаємодії), а від числа зіткнень активних молекул. Результати зіткнення здатних до взаємодії молекул залежить від їх стану. Молекули при низьких температурах малоактивні, а в разі нагрівання та освітлення їх активність збільшується. Активні молекули – це збудженні молекули у яких під впливом нагрівання посилюється обертальний рух атомів і атомних груп, зо зумовлює збудження електронів зовнішнього енергетичного рівня. Щоб звичайним молекулам надати активності, потрібно затратити так звану енергію активації.
По енергії активації можна говорити про швидкість ракцій, які проходять:
до 40 кДж/моль – миттєво.
70-80 кЖд/моль реакції із середньою швидкістю;
120 і більше кЖд/моль повільно.
Активність молекул в першу чергу залежить від природи реагуючих речовин. Ясно чим активніший метал, тим швидкість реакції буде більшою. Лужні метали миттєво вступають у реакції, тому що вони мають дуже низьку енергію активації, яка б сповільнювала процес. Лужноземельні мають трішки вищу енергію активації, але все ж таки за звичайних умов реакції також відбуваються з великою швидкістю. (слайд № 9)
Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції.
Вона необхідна для подолання енергетичного бар’єра.
Наявність енергетичного бар’єра приводить до того, що багато реакцій, перебіг яких повністю можливий, самочинно не починається. Наприклад, вугілля, деревина, нафта, здатні окислюватися і горіти на повітрі, за звичайних умов не спалахують. Це пов’язано з великою енергією активації відповідних реакцій окиснення. Підвищення температури збільшує кількість активних молекул, і тому все більше молекул кисню, вугілля, деревини в нафти набувають необхідний запас енергії для початку реакції. За певної температури швидкість реакції досягає певної величини, і починається реакція горіння.
Перш ніж почнуть утворюватись нові хімічні зв'язки, мають бути ослаблені або розірвані зв'язки між атомами у вихідних молекулах. Для цього потрібно затратити енергію. Так, у реакції водню з йодом
Н2 + І2 = 2НІ
під час зіткнення молекул починають подовжуватись зв'язки Н—Н та І—І. Вони послаблюються і тільки після цього починають утворюватись нові зв'язки Н—І. У результаті виникає угруповання
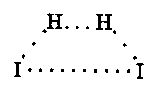
яке називають активованим комплексом, або перехідним станом.
Після утворення перехідного стану відбувається процес подальшої побудови нових зв'язків і остаточного розриву вихідних зв'язків. Процес хімічного перетворення можна відобразити такою схемою:
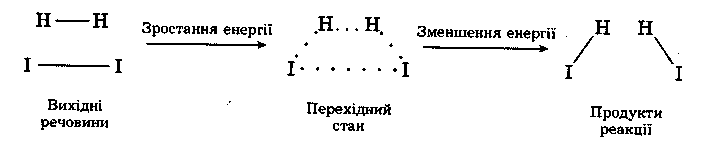
Таким чином, під час хімічного процесу перехід системи вихідних речовин із енергетичного стану Евих в енергетичний стан Епр здійснюється через енергетичний бар’єр, який дорівнює енергії активації системи Е0.
Для ендотермічної реакції енергія продуктів реакції більша, ніж енергія вихідних речовин, для екзотермічної, навпаки, енергія продуктів менша за енергію вихідних речовин. Однак в обох випадках між вихідними речовинами і продуктами реакції утворюється активований комплекс, що має підвищену енергію.
Енергія активації DЕакт є важливою характеристикою хімічних перетворень. Саме енергія активації затримує чи робить неможливими багато реакцій, які з точки зору термодинаміки можуть перебігати самочинно. Якщо б енергія активації для всіх реакцій дорівнювала нулю( тобто її не було б), то в природі відбувалася безліч хаотичних хімічних реакцій. Так, вугілля і нафта при контакті з повітрям загоралися б, азот повітря і вода утворювали б розчин нітратної кислоти, живі б клітини зруйнувалися внаслідок гідролізу.
Таким чином, існування більшості молекул, кристалічних речовин і навіть живі клітини можливо тому, що процеси їх перетворення і руйнування пов’язані з подоланням значного енергетичного бар’єра. (слайд № 10).
Висновок: Швидкість визначається зміною концентрації речовини, яка реагує, або утворюється за одиницю часу в одиниці реакційної суміші ( об’єму- для гомогенної, та площі поверхні для гетерогенної). Швидкість залежить від природи реагуючих речовин, які в свою чергу можуть легко активуватися. Активні молекули – це ті, що мають надлишок енергію. Іншими словами збудженні молекули. Щоб цим молекулам надати енергії потрібно її затратити, тобто перевести у збуджений стан. Ця енергія називається енергією активації. Вона дорівнює різниці енергії, між збудженим станом та не збудженим.
