
- •Лекція 4
- •План лекції
- •Зміст лекції:
- •Гібридизація атомних орбіталей, типи гібридизації. Умови стійкої гібридизації. Стереохімія молекул
- •2. Поляризація ковалентного зв’язку. Неполярний і полярний ковалентний зв’язок.
- •3. Іонний зв’язок як крайній випадок поляризації ковалентного зв’язку, інші види зв’язку.
- •1. Голубєв а.В., Лисін в.І., Коваленко, Тарасенко г.В, Хімія. - к.: Кондор, 2013 стр. 88-100
- •2. Цвєткова л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 4.1-4.2;
- •3. Романова н.В. Загальна та неорганічна хімія. - к.:Ірпінь, 2004 § 1.1; 2.1-2.2.
Лекція 4
Тема. Характеристика ковалентного зв’язку.
План лекції
1. Гібридизація атомних орбіталей, типи гібридизації. Умови стійкої гібридизації. Стереохімія молекул
2. Поляризація ковалентного зв’язку. Неполярний і полярний ковалентний зв’язок
3. Іонний зв’язок як крайній випадок поляризації ковалентного зв’язку, інші види зв’язку.
Література:
1. Голубєв А.В., Лисін В.І., Коваленко, Тарасенко Г.В, Хімія. - К.: Кондор, 2013 стр. 88-100
2. Цвєткова Л.Б. Неорганічна хімія: теорії і задачі. Львів: «Магнолія», 2013. § 4.1-4.2;
3. Романова Н.В. Загальна та неорганічна хімія. - К.:Ірпінь, 2004 § 1.1; 2.1-2.2.
Зміст лекції:
Гібридизація атомних орбіталей, типи гібридизації. Умови стійкої гібридизації. Стереохімія молекул
Просторову будову багатьох молекул, а саме утворення певних кутів між напрямками зв'язків, важко пояснити з точки зору використання атомами тільки атомних орбіталей. Здавалося б, що ці кути можуть бути тільки близькими до прямих. Але відома значна кількість експериментальних даних, які свідчать, що існують лінійні молекули з розгорнутим кутом 180° (ВеС12, С02, N20, С2Н2), частинки з кутом між зв’язками, близьким до 120° (Оз, S02, С2Н4, ВF3, С032- та ін.), або близьким до 109° (СН4, NН4+, Н20, NH3 та ін.). Пояснити виникнення таких кутів, виходячи з незмінності атомних орбіталей при утворенні зв'язків, виявляється неможливим.
Теоретичне обгрунтування цього факту було запропоновано Дж.К. Слейтером і Л.К. Полінгом. Вони показали, що при розгляді та розрахунках хімічного зв’язку кілька різних орбіталей, які енергетично не дуже відрізняються, можна замінити тією самою кількістю однакових орбіталей. Такі орбіталі називаються гібридними.
Атомні s-, р-, а іноді і d-орбіталі перетворюються у гібридні при утворенні хімічного зв'язку. Це супроводжується зміною форми атомних орбіталей, які змішуються, перетворюючись в орбіталі однакової форми.
Таким чином, гібридизація полягає у зміні форми і виникненні енергетично рівноцінних орбіталей при утворенні хімічного зв'язку із початково нееквівалентних атомних орбіталей.
Гібридні орбіталі несиметричні, вони мають витягнуту форму, тобто невелике значення з одного боку від ядра і більше - з іншого боку. Це призводить до кращого перекривання орбіталей при утворенні зв'язку, завдяки чому зв’язок між сполученими атомами стає міцнішим. Поверхня гібридної орбіталі має вигляд:

Взаємне розміщення в просторі декількох гібридних орбіталей, які утворюються, відносно атомного ядра залежить від кількості АО (атомних орбіталей), що приймають участь в гібридизації.
В гібридизації можуть брати участь не тільки одноелектронні, а також і двохелектронні атомні орбіталі. В гібридизації не приймають участь вільні атомні орбіталі та ті одноелектронні орбіталі, які утворюють σ-зв'язки.
Згідно з теорією гібридизації, кількість гібридних орбіталей дорівнює кількості вихідних атомних орбіталей. Розрізняють такі типи гібридизації:
sр-Гібридизація
При перекриванні однієї s-орбіталі з однією р-орбіталлю, утворюються дві гібридні орбіталі, спрямовані у протилежні боки від ядра під кутом 180°. Такий тип гібридизації називається sр-гібридизацією. sр-Гібридизацією пояснюється лінійна структура трьохатомних молекул (ВеС12, С02, N20) або молекул ацетиленових вуглеводнів.
Наприклад, при утворенні хімічного зв’язку в молекулі ВеС12 у атома Берилію відбувається гібридизація одної 8- з однією р-орбіталлю. Атом Берилію у незбудженому стані не має неспарених електронів (1s22s22р°), тому для участі в утворенні хімічного зв'язку атом Берилію має перейти у збуджений стан (1s22s12р1). У збудженому стані атом Берилію має два неспарених електрони - один s- і один р-електрон. Гібридизація s- і р-орбіталей призводить до утворення двох sр-гібридних орбіталей, які розміщені симетрично під кутом 180°:
Кожний атом Хлору,
який міститься в молекулі ВеСl-, має
один неспарений електрон, що приймає
участь в утворенні ковалентного зв'язку:
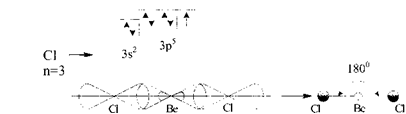
Зв'язки, які утворюються за участю електронів цих орбіталей, також розміщуються під кутом 180°. Молекула ВеСl2 має лінійну будову, усі три атоми розміщуються на одній лінії, яка з'єднує центри атомів (такий тип гібридизації має місце також при утворенні галогенідів Zn, Сd, Нg, атоми яких у збудженому стані мають неспарені s- і р-електрони).
sp2-Гіридизація
При перекриванні однієї s- і двох р-орбіталей, утворюються три гібридні орбіталі, які розташовані у площині під кутом 120° одна до одної. Такий тип гібридизації називається sр2-Гібридизація.
За рахунок більшої, порівняно з sр-гібридизацією, часткою участі р-орбіталей у sр2-гібридизації гібридні орбіталі є більш витягнутими у просторі в напрямку зв'язку.
Такий тип гібридизації характерний для молекул елементів III групи періодичної системи, атоми яких у збудженому стані мають електронні структури ns1np2, що утворюють гібридні зв'язки (ВFз, ВСІз, АІFз, АІСІз тощо).
Наприклад, в молекулі ВСІ3 атом Бору утворює три рівноцінні зв'язки з атомами Хлору, які розташовані у просторі під кутом 120°. Оскільки молекула має плоску будову з кутом 120° між зв'язками В-С1, атом Бору знаходиться у sp2 –гібридному стані:
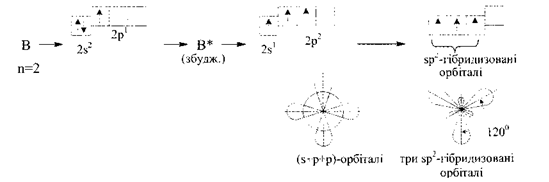
Внаслідок sр2-гібридизації орбіталей атома Бору молекули галогенідів Бору (ВF3, ВСІз, Н3В03, В(СНз)з) мають форму плоского рівностороннього трикутника з атомом Бору в центрі:
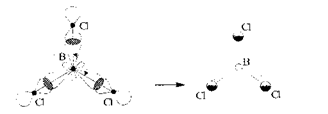
Видно, що а-зв'язки утворюються за рахунок перекривання одноелектронних р-орбіталей Хлору і трьох sр2-гібридних одноелектронних орбіталей Бору, одна р-орбіталь Бору залишається негібридизованою. На ній електрони відсутні і вона є вакантною.
Кути 120°, або близькі до них, виникають також у молекулах С2Н4, SО2, 03, іоні С032_, і тому вважають, що у них, відповідно, атоми Карбону, Сульфуру і Оксигену знаходяться у sр2-гібридному стані.
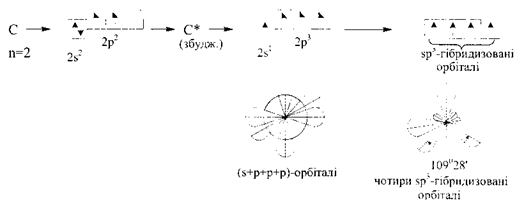
sp3-Гіридизація
При утворенні зв'язків можуть перекриватися одна s- і три р-орбіталі. При такому перекриванні утворюються чотири гібридні орбіталі в стані sр3-гібридизації. Оскільки при цьому частка р-хмар ще більша, ніж у випадку sр2-гібридизації, відносно s-орбіталі, кожна така гібридна орбіталь ще більше подовжується у напрямку зв'язку.
Просторово чотири гібридні орбіталі розташовуються від центра тетраедра до його вершин, утворюючи кути 109°28’.
Тетраедрична будова відома для багатьох молекул та молекулярних іонів (СН4, NН4, та ін.). Вважається, що атоми, які утворюють зв'язки, розташовані під кутами, близькими до 109°28’, знаходяться у sр3-гібридизованому стані.
Наприклад, в молекулі метану СН4 Карбон утворює чотири рівноцінні за довжиною і енергією зв'язки з Гідрогеном, які просторово розміщені під кутом 109°28\ Отже, Карбон при виникненні зв'язків перебудовує початково нерівноцінні s- і р-орбіталі у чотири еквівалентні sр3-гібридні орбіталі, які перекриваються з одноелектронними орбіта лями Гідрогенy.
У випадку різних замісників у центральних атомів кути між зв'язками можуть змінюватися внаслідок різної полярності зв'язків. Просторову симетрію молекул можна визначати за їх дипольними моментами. Так дипольні моменти зв'язків в молекулах ВеС12 і ВС13 спрямовані радіально від центру і їх результуюча дорівнює нулю. Це підтверджується експериментальними дослідженнями. Наприклад, електронографічними дослідженнями була підтверджена тетраедрична будова ССІ4 і SiF4, тригональна будова ВF3, пірамідальна будова РС13 і геометрична конфігурація багатьох інших молекул.
Умовою стійкої гібридизації є : виникнення кутів між зв'язками при утворенні молекул сприяє такому просторовому розміщенню гібридних орбіталей, завдяки якому досягається найменше відштовхування між електронами зв'язків і яке виявляється енергетично найбільш доцільним.
Слід відзначити, що окремий тип гібридизації не є якоюсь властивістю певного елементу. Гібридизація - це є метод, який перебудовою атомних орбіталей у гібридні пояснює властивості будови конкретної молекули та конкретних зв'язків.
Стереохімія – це розділ хімії, який вивчає просторове розміщення молекул (в органічній хімії її ще називають геометричною структурою молекул). При утворенні молекул хімічних сполук електронна густина часто зміщується у бік більше електронегативного атому, внаслідок чого утворюються полярні молекули (диполі). Мірою полярності молекули є її дипольний момент це - це добуток довжини диполю l на заряд електрону (1,6 10 19 Кл). Дипольний момент молекули має значення приблизно 10 29 Кл Його найчастіше вимірюють у дебаях D (1D= 3,33.Ю"30 Кл-м).
Для двохатомних молекул величина дипольного моменту обумовлена характером атомів, які входять до їх складу. В молекулах типу A2 центри позитивних і негативних зарядів збігаються. Такі молекули неполярні. У молекулах типу АВ зв’язок має полярний характер і самі молекули завжди полярні. В багатоатомних молекулах типів АВ2, АВ3, АВ4 та ін. полярність зв’язку А-В не завжди призводить до полярності молекул в цілому. Полярність молекули в цьому випадку істотно залежить і від просторової конфігурації.
В симетричних молекулах: АВ2 (лінійна з атомом А у центрі
І
![]()
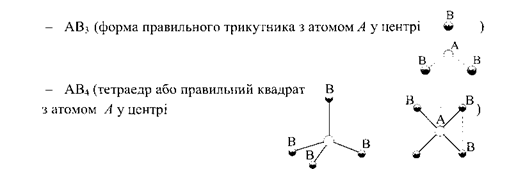
дипольні моменти зв’язків АВ взаємно компенсують один одного, внаслідок чого сумарний дипольний момент таких молекул дорівнює нулю.
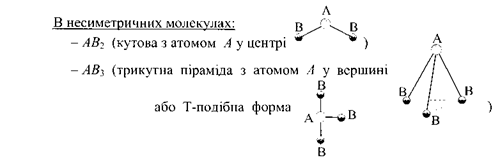
та в інших багатоатомних молекулах взаємної компенсації дипольних моментів не відбувається, і молекула в цілому полярна. Отже, на основі експериментального визначення дипольних моментів молекул можна зробити висновки про їхню будову.
