
- •1. Характеристика физической величины
- •1.1 Количество электричества и электрический заряд
- •1.2 Формула нахождения количества электричества
- •1.3 Единица измерения электрического заряда
- •1.4 Свойства электрического заряда
- •1.5 Закон сохранения электрического заряда.
- •2. Приборы для измерения количества электричества и их принципы работы
- •2.1 Электрометр
- •2.2 Химический кулонометр
- •2.3 Баллистический гальванометр
- •2.4 Счетчик ампер-часов
- •3. Пример измерения количества электричества при техническом обслуживании и ремонте автомобилей.
1.5 Закон сохранения электрического заряда.
Внутри замкнутой системы при любых взаимодействиях алгебраическая сумма электрических зарядов остается постоянной:
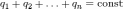
Изолированной (или замкнутой) системой мы будем называть систему тел, в которую не вводятся извне и не выводятся из нее электрические заряды.
Нигде и никогда в природе не возникает и не исчезает электрический заряд одного знака. Появление положительного электрического заряда всегда сопровождается появлением равного по модулю отрицательного заряда. Ни положительный, ни отрицательный заряд не могут исчезнуть в отдельности, они могут лишь взаимно нейтрализовать друг друга, если равны по модулю.
Так элементарные частицы способны превращаться друг в друга. Но всегда при рождении заряженных частиц наблюдается появление пары частиц с зарядами противоположного знака. Может наблюдаться и одновременное рождение нескольких таких пар. Исчезают заряженные частицы, превращаясь в нейтральные, тоже только парами. Все эти факты не оставляют сомнений в строгом выполнении закона сохранения электрического заряда.
Причина сохранения электрического заряда до сих пор пока неизвестна.
2. Приборы для измерения количества электричества и их принципы работы
2.1 Электрометр
Для обнаружения и измерения электрических зарядов применяется электрометр. Электрометр состоит из металлического стержня и стрелки, которая может вращаться вокруг горизонтальной оси (рис. 1). Стержень со стрелкой закреплен в плексигласовой втулке и помещен в металлический корпус цилиндрической формы, закрытый стеклянными крышками.
Принцип работы электрометра. Прикоснемся положительно заряженной палочкой к стержню электрометра. Мы увидим, что стрелка электрометра отклоняется на некоторый угол (см. рис. 1). Поворот стрелки объясняется тем, что при соприкосновении заряженного тела со стержнем электрометра электрические заряды распределяются по стрелке и стержню. Силы отталкивания, действующие между одноименными электрическими зарядами на стержне и стрелке, вызывают поворот стрелки. Наэлектризуем эбонитовую палочку еще раз и вновь коснемся ею стержня электрометра. Опыт, показывает, что при увеличении электрического заряда на стержне угол отклонения стрелки от вертикального положения увеличивается. Следовательно, по углу отклонения стрелки электрометра можно судить о значении электрического заряда, переданного стержню электрометра.

Рис. 1
2.2 Химический кулонометр
Измерение количества электричества, эквивалентного содержанию окисляемого или восстанавливаемого вещества, надлежащего определению, можно выполнить с помощью либо химического кулонометра, либо интегратора ток - время, соединенных последовательно с кулонометрической ячейкой. Химические кулонометры представляют собой электрохимические ячейки, в которых протекают определенные реакции с 100 % - ной эффективностью тока, В серебряном кулонометре серебро выделяется количественно из раствора нитрата серебра на платиновом катоде, который взвешивают, определяя таким образом количество металлического серебра и эквивалентное ему количество электричества в Кл, прошедшее через раствор в процессе электролиза. В водородно-кислородном кулонометре с двумя платиновыми электродами происходит электролиз разбавленного водного раствора сульфата калия. Вода окисляется до кислорода на аноде, в то время на катоде образуется газообразный водород. Эти газы собирают вместе в закрытую камеру, помещенную над раствором сульфата калия, измеряют их объем при известной температуре и давлении и затем вычисляют количество электричества. Иногда вместо раствора сульфата калия подвергают электролизу раствор гидразинсульфата; в этом случае у анода образуется газообразный азот.

