- •1 Тақырып
- •1 Элементарлы бөлшектер және атом ядросы
- •2 Атомның электрондық қабатының құрылымы
- •2.1 Электронның екі дайлылық табиғаты
- •2.2 Квант сандары
- •Типтік есеп № 1
- •Шығарылуы
- •3 Атомның электрондық формулалары
- •Типтік есеп № 2
- •Шығарылуы
- •4 Элементтер периодтық жүйесінің құрылымы
- •Шығарылуы
- •5 Элементтер атомдарының қасиеттері және олардың өзгеруінің мерзімділігі
- •Типтік есеп № 4
- •Шығарылуы
- •6 Өзіндік жұмыс тапсырмалары
- •2 Тақырып Химиялық кинетика. Химиялық тепе-теңдік
- •1 Химиялық реакция жылдамдығы туралы түсінік
- •2 Әрекеттесуші заттар концентрациясының әсері
- •Типтік есеп №1
- •Шығарылуы
- •3 Реакция жылдамдығына температураның әсері
- •Типтік есеп №2
- •Шығарылуы
- •4 Химиялық реакция жылдамдығына катализатордың әсері
- •Типтік есеп №3
- •Шығарылуы
- •5 Химиялық тепе-теңдіктің негізгі түсініктері мен белгілері
- •1) Қайтымды реакция кезінде тура және кері процестердің жылдамдықтары теңесетін жылжымалы химиялық тепе-теңдік орнайды: .
- •6 Тепе-теңдік жүйе үшін әрекеттесуші массалар заңы
- •Типтік есеп №4
- •Шығарылуы
- •7 Химиялық тепе-теңдіктің ығысуы. Ле-Шателье қағидасы
- •Типтік есеп №5
- •Шығарылуы
- •8 Өзіндік жұмысқа тапсырмалар
- •3 Тақырып Электролит ерітінділері
- •1 Күшті және әлсіз электролиттер
- •1.1 Электролиттік диссоциациялану дәрежесі
- •1.2 Электролиттік диссоциациялану тұрақтысы
- •1.3 Оствальдтың сұйылту заңы
- •Типтік есеп№ 1
- •Шығарылуы
- •2 Бейорганикалық қосылыстардың әртүрлі кластарының электролиттік диссоциациялануы
- •3 Иондық реакциялар
- •Типтік есеп № 2
- •Шығарылуы
- •4 Судың диссоциациялануы. Судың иондық көбейтіндісі
- •Типтік есеп №3
- •Шығарылуы
- •5 Өзіндік жұмысқа тапсырмалар
- •4 Тақырып Тотығу-тотықсыздану реакциялары
- •1 Тотығу дәрежесі
- •Типтік есеп №1
- •Шығарылуы
- •2 Тотығу-тотықсыздану процестердің негізі
- •Типтік есеп №2
- •Шығарылуы
- •3 Тотығу-тотықсыздану реакциялардың теңдеулерін құрастыру әдістері
- •3.1 Электрондық баланс әдісі
- •Типтік есеп № 3
- •Шығарылуы
- •3.2 Иондық-электрондық баланс әдісі (жартылай реакциялар әдісі)
- •Типтік есеп № 4
- •Шығарылуы
- •4 Тотықсыздандырғыш пен тотықтырғыш эквивалентінің молярлы массасы
- •Типтік есеп № 5
- •Шығарылуы
- •5 Өзіндік жұмыс тапсырмалары
- •5 Тақырып Электрохимия негіздері. Гальваникалық элементтер
- •1 Стандартты электродтық потенциал. Нернст теңдеуі
- •2 Электродтардың жіктелуі
- •Типтік есеп № 3
- •Шығарылуы
- •Типтік есеп № 4
- •Шығарылуы
- •Типтік есеп № 5
- •Шығарылуы
- •3 Гальваникалық элемент. Гальваникалық элементтің эқк
- •3.1 Гальваникалық элемент туралы жалпы тұрғылар
- •3.2 Гальваникалық элемент жұмысының сұлбасы
- •3.3 Химиялық және концентрациялық гальваникалық элементтер
- •Типтік есеп № 6
- •Шығарылуы
- •Типтік есеп № 7
- •Шығарылуы
- •4 Өзіндік жұмысқа тапсырмалар
- •6 Тақырып Электролиз
- •1 Электролиз туралы түсінік
- •2 Электродтық процестердің өту реттілігі
- •2.1 Электролит балқымасының электролизі
- •2.2 Электролит ерітіндісінің электролизі
- •Типтік есеп №1
- •Шығарылуы
- •3 Электролиз заңдары
- •3.1 Электролиздің бірінші заңы
- •3.2 Электролиздің екінші заңы
- •Типтік есеп № 2
- •Шығарылуы
- •Типтік есеп № 3
- •Шығарылуы
- •4 Өзіндік жұмысқа тапсырмалар
- •7 Тақырып
- •1 Коррозиялық процестердің жіктелуі
- •2 Электрохимиялық коррозия
- •2.1 Электрохимиялық коррозияның механизмі
- •2.2 Электрохимиялық коррозияның сұлбасы
- •Типтік есеп № 1
- •Шығарылуы
- •3 Металдарды коррозиядан қорғау
- •3.1 Металдардың беттік қорғаныс жабындары
- •3.2 Коррозияға қарсы қабілеттілігі бар құймаларды жасау
- •3.3 Электрохимиялық әдістер
- •3.4 Ортаның құрамын өзгерту
- •Типтік есеп № 3
- •Шығарылуы
- •Типтік есеп № 4
- •Шығарылуы
- •Типтік есеп № 5
- •Шығарылуы
- •4 Өзіндік жұмысқа тапсырмалар
- •1 Қосымша
- •2 Қосымша
- •3 Қосымша
- •Әдебиеттер тізімі
- •Мазмұны
6 Тақырып Электролиз
1 Электролиз туралы түсінік
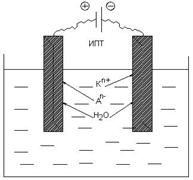
Электролиз деп электролиттің ерітіндісі немесе балқымасы арқылы электр тоғы өткенде электродтарда пайда болатын тотығу-тотықсыздану процесін айтады.
1) Электролиз процесі өтетін аппараттар (немесе ыдыстар) электролизерлар немесе электролиздік ванналар деп аталады. Электролизер электролит ерітіндісі немесе балқымасы бар ыдыстан және тұрақты ток көзіне қосылған электродтардан тұрады.
|
|
|
|
![]()
![]() Электролит
КА Кn+
+ Аn-
электролизер
Электролит
КА Кn+
+ Аn-
электролизер
(сулы ерітінді) Н2О
2) Тотығу (электрондарды беру) процесі өтетін электрод анод деп аталады. Анод электролиз кезінде тұрақты ток көзінің оң полюсіне қосылады. Электролизерда ол оң таңбалы «+» болады (электрондарды беріп, оң зарядталады).
Анодтар еритін (белсенді) және ерімейтін (инертті) болады. Ерімейтін анодтарды платина, палладий, графиттан жасайды, соңғы кездері оксидтік рутений-титанды анодтар қолданылады (ОРТА). Ерімейтін анодтар электролиз кезінде тотықпайды. Еритін анодтар (мыс, темір, никель, мырыш ж.т.б.) электролиз кезінде тотығады.
3) Тотықсыздану (электрондарды қосып алу) процесі өтетін электрод катод деп аталады. Катод электролиз кезінде тұрақты ток көзінің теріс полюсіне қосылады. Электролизерда ол теріс таңбалы «-» болады (электрондарды қосып алу нәтижесінде теріс зарядталады). Катодтар электролиз кезінде тотықсызданбайтындықтан, оларды кез келген ток өткізетін материалдан жасауға болады.
4) Электролизерда тотығу-тотықсыздану реакциясы өздігінен жүрмейді, сондықтан электролизерда өтетін тотығу-тотықсыздану реакциялардың ΔG (Гиббс энергиясы) әрқашан > 0; ал ЭҚК әрқашан < 0.
5) Электролизерда электролиттің ыдырауы өту үшін электродтарға ток көзінен потенциалдардың кез келген айырымын емес, берілген электролиттің ыдырауына қажетті мөлшерін ғана береді. Потенциалдардың мұндай айырымын электролиттің ыдырау кернеуі деп атайды.
2 Электродтық процестердің өту реттілігі
2.1 Электролит балқымасының электролизі
Тұздар балқымаларын электролиздегенде катодта белсенді және белсенділігі төменірек металдар катиондарының тотықсыздануы, ал анодта – оттексіз және оттекті қышқылдар аниондарының тотығуы жүреді. Оттекті қышқылдар аниондары тотыққанда әртүрлі өнімдер қоспасы түзіледі.
Мысалы, жоғары температураларда КВr балқып, иондарға ыдырайды: KBr → K+ + Br . Бұл иондар электродтарда разрядталады.ем разряжаются на электродах. КВr балқымасының электролиз процесінің сұлбасы келесі:
KBr
(С)
К (-)
![]() (+)
A
(С )
(+)
A
(С )
← К+ + Вr →
(-)
K:
К+
![]() К
2
К
2
(+) A: 2Br Br2 1
![]()
![]() 2К+
+ 2Вr
электролиз
2K
+ Br2
2К+
+ 2Вr
электролиз
2K
+ Br2
![]() 2KBr
электролиз
2K
+ Br2.
2KBr
электролиз
2K
+ Br2.