- •Физика Лабораторный практикум
- •Содержание
- •Пояснительная записка
- •Уважаемый студент!
- •Лабораторная работа № 1 Обработка результатов измерений
- •I. Порядок выполнения лабораторных работ
- •II. Правила поведения и техника безопасности при проведении лабораторных работ
- •III. Оценка погрешностей измерений
- •Лабораторная работа № 2 Проверка уравнения состояния идеального газа для постоянной массы газа Теоретическая часть
- •I. Определение относительной влажности воздуха с помощью психрометра Августа.
- •II. Определение относительной влажности воздуха с помощью гигрометра Ламбрехта.
- •Лабораторная работа № 5 Определение коэффициента линейного расширения твердого тела
- •Лабораторная работа № 7 Определение электродвижущей силы и внутреннего сопротивления источника электрической энергии
- •Лабораторная работа № 8 Определение удельного сопротивления проводника
- •Лабораторная работа № 9 Изучение законов последовательного и параллельного соединений потребителей электрической энергии
- •Лабораторная работа № 10 Исследование зависимости мощности, потребляемой лампой от напряжения на ее зажимах
- •Мощность электробытовых приборов и расход электроэнергии
- •Лабораторная работа № 11 Определение электрохимического эквивалента меди
- •Примесная проводимость p- и n-типа
- •Лабораторная работа № 14 Определение силы света источника
- •Лабораторная работа № 16 Определение длины световой волны с помощью дифракционной решетки
- •Список литературы
Лабораторная работа № 2 Проверка уравнения состояния идеального газа для постоянной массы газа Теоретическая часть
Соотношение p = nkT, связывающее давление газа с его абсолютной температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это уравнение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
![]()
Здесь N – число молекул в сосуде, NA – постоянная Авогадро, m – масса газа в сосуде, M – есть молярная масса газа. В итоге получим:
![]()
Произведение постоянной Авогадро NA на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = 8,31 Дж/моль·К.
Соотношение
![]() или
или
![]() (*)
(*)
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид: pV=RT.
Если температура газа равна Tн= 273,15 К (0 °С), а давление pн=1 атм=1,013·105 Па, то говорят, что газ находится при нормальных условиях. Из уравнения состояния идеального газа следует, что один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный
V0 = 0,0224 м3/моль.
Это утверждение называется законом Авогадро.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение (*) можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс.
Вопросы
Дайте понятие макроскопических и микроскопических параметров газа.
Приведите формулу, устанавливающую связь между микроскопическими и макроскопическими параметрами газа.
Что означает число Авогадро?
Что называется универсальной газовой постоянной?
Запишите уравнение состояния газа для одного моля газа.
Запишите уравнение состояния газа для произвольной массы. Приведите формулу.
Из уравнения Клапейрона-Менделеева получите формулы для изотермического, изобарического и изохорического процессов в газах (уравнение Бойля-Мариотта, Гей-Люссака и Шарля) и изобразите эти законы графически в осях p(V).
Цель работы: опытным путем проверить взаимосвязь между термодинамическими параметрами газа при постоянной массе газа.
Оборудование: стеклянная трубка, термометр, барометр, сосуды с горячей и холодной водой.
Ход работы:
Измерить в мм рт.ст. величину атмосферного давления по барометру (р1).
Измерить в мм длину воздушного столба в трубке (h1) и считать ее в дальнейшем численно равной объему воздуха (V1) h1 = V1 (V1 = S∙ h1, V2 = S∙ h2, S = const).
Открытым концом вверх погрузить до краев трубку в сосуд с горячей водой, несколько выждать.
Измерить температуру горячей воды и выразить ее в Кельвинах (Т1).
Зажав открытый конец трубки пальцем, вытащить ее из горячей воды и опустить полностью в сосуд с холодной водой открытым концом вниз и убрать палец, несколько выждав.


Горячая вода Холодная вода
Измерить температуру холодной воды и выразить ее в Кельвинах (Т2).
Достать трубку из холодной воды.
Измерить в мм длину воздушного столба в трубке (h2), считать ее равной объему воздуха (V2) h2 = V2.
Давление воздушного столба во втором случае вычислить по формуле
![]() ,
,
13,6 – переводной коэффициент от мм водного столба в мм рт. ст.
Вычислить
 и
и
 (Вычисления произвести до целых).
(Вычисления произвести до целых).Результаты измерений и вычислений занести в таблицу
Атмосферное давление (р1), мм рт.ст.
Давление газа (р2),
мм рт.ст.
Объем газа (V1),
мм3
Объем газа (V2),
мм3
Температура газа (T1), К
Температура газа (Т2), К
С1
С2
Вычислить абсолютную и относительную погрешности, записать ответ в установленной форме.
Сформулировать и записать вывод.
Ответить на контрольные вопросы:
- Почему трубка должна быть погружена полностью в воду? - Чему равно численное значение атмосферного давление при нормальных условиях?
Тест
Какой формулой описывается закон Менделеева-Клапейрона?
а)
![]() ,
,
б) ![]() ,
,
в) ![]() ,
,
г) ![]() .
.
К


 акой
график описывает изохорический процесс
в газе?
акой
график описывает изохорический процесс
в газе?
а) б) в)
Укажите формулу объединенного газового закона.
а) ![]() ,
,
б) ![]() ,
,
в) ![]() ,
,
г) ![]() .
.
Как читается уравнение состояния газа для постоянной массы газа?
А. Для постоянной массы газа произведение давления на объем и отнесенное к температуре есть величина постоянная.
Б. Для постоянной массы газа произведение давления на объем и отнесенное к термодинамической температуре есть величина постоянная.
В. Произведение давления на объем и отнесенное к термодинамической температуре есть величина постоянная.
В баллоне емкостью 20 л находится кислород под давлением 100 атм. при температуре 17 оС. Какой объем занимал бы он при нормальных условиях?
а) 0,5 м3
б) 1,82 м3
в) 20 м3
г) 18 м3
Лабораторная работа № 3
Определение относительной влажности воздуха
Теоретическая часть
Физическая величина, характеризующая содержание в воздухе водяного пара, называется влажностью воздуха. Относительная влажность воздуха – это отношение парциального давления (или концентрации молекул) водяного пара, содержащегося в воздухе при данной температуре, к давлению (концентрации) насыщенного пара при той же температуре. Выражается:

Относительная влажность воздуха показывает, насколько водяной пар в данных условиях близок к насыщению. Именно от этого зависит интенсивность испарения воды и потеря влаги живыми организмами. Для человека наиболее благоприятна относительная влажность, равная 40–60%.
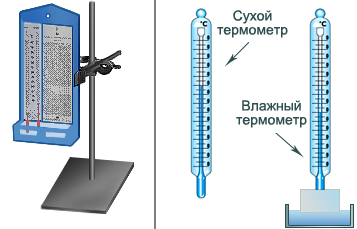
Для измерения влажности используют зависимость различных параметров веществ от влажности воздуха. Такими параметрами могут служить, например, скорость испарения воды (психрометр, рис. 1), температура выпадения росы при локальном охлаждении воздуха (гигрометр, рис. 2), удлинение волоса при заданной нагрузке (волосяной гигрометр), сопротивление полупроводников (электронный измеритель влажности).
|
С помощью гигрометра измеряют точку росы – температуру, до которой необходимо охладить воздух, чтобы содержащийся в нем водяной пар, остывая, стал насыщенным. Начиная с этой температуры, охлаждение воздуха сопровождается появлением капелек росы на зеркальном сосуде, температуру которого понижают, прокачивая грушей воздух через легкокипящую жидкость (рис. 2). С помощью психрометра фиксируют разницу температур двух термометров – сухого и влажного (рис. 1). По этой разнице и температуре сухого термометра устанавливают влажность воздуха по психрометрической таблице.
Вопросы:
MO_2002_05V_A009 |
Какие виды влажности вам известны?
Как определить абсолютную влажность воздуха?
Что показывает относительная влажность воздуха?
При какой влажности воздуха человек легче переносит высокую температуру воздуха и почему?
Когда влажность воздуха равна 100%?
Температура воздуха toC, давление воздуха равно p0, парциальное давление паров в воздухе p, давление насыщенных паров при температуре toC равно pнп. Относительная влажность воздуха равна...
Что называется точкой росы?
Цель работы: научиться опытным путем определять относительную влажность воздуха с помощью различных приборов.
Оборудование: психрометр Августа, гигрометр Ламбрехта, термометр, психрометрическая таблица, таблица «Плотность и давление насыщающих паров».
Теория. Дать определение:
- абсолютной влажности воздуха; - относительной влажности воздуха; - точки росы.
Ход работы