
- •Физика Лабораторный практикум
- •Содержание
- •Пояснительная записка
- •Уважаемый студент!
- •Лабораторная работа № 1 Обработка результатов измерений
- •I. Порядок выполнения лабораторных работ
- •II. Правила поведения и техника безопасности при проведении лабораторных работ
- •III. Оценка погрешностей измерений
- •Лабораторная работа № 2 Проверка уравнения состояния идеального газа для постоянной массы газа Теоретическая часть
- •I. Определение относительной влажности воздуха с помощью психрометра Августа.
- •II. Определение относительной влажности воздуха с помощью гигрометра Ламбрехта.
- •Лабораторная работа № 5 Определение коэффициента линейного расширения твердого тела
- •Лабораторная работа № 7 Определение электродвижущей силы и внутреннего сопротивления источника электрической энергии
- •Лабораторная работа № 8 Определение удельного сопротивления проводника
- •Лабораторная работа № 9 Изучение законов последовательного и параллельного соединений потребителей электрической энергии
- •Лабораторная работа № 10 Исследование зависимости мощности, потребляемой лампой от напряжения на ее зажимах
- •Мощность электробытовых приборов и расход электроэнергии
- •Лабораторная работа № 11 Определение электрохимического эквивалента меди
- •Примесная проводимость p- и n-типа
- •Лабораторная работа № 14 Определение силы света источника
- •Лабораторная работа № 16 Определение длины световой волны с помощью дифракционной решетки
- •Список литературы
Лабораторная работа № 11 Определение электрохимического эквивалента меди
Теоретическая часть
Водные растворы неорганических кислот, солей и оснований являются проводниками второго рода, их называют электролитами. В них протекание электрического тока сопровождается переносом вещества, а носителями свободных зарядов являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов с металлоидами в расплавленном состоянии, а также некоторые твердые вещества.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
![]()
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают но одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4
(медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
![]()
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом: SO4 + Cu = CuSO4.
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.

Рис. 1
Электролиз водного раствора хлорида меди.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит: m = kQ = kIt.
Величину k называют электрохимическим эквивалентом.
М![]() асса
выделившегося на электроде вещества
равна массе всех ионов, пришедших к
электроду:
асса
выделившегося на электроде вещества
равна массе всех ионов, пришедших к
электроду: ![]()
Здесь m0 и q0 – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
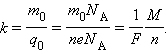
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея. F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
![]()
Явление электролиза широко применяется в современном промышленном производстве.
В промышленности, пропуская ток через раствор или расплав, получают некоторые чистые элементы (Al, Cu,Cl2, Na). Так как выделяющийся металл может оседать на материале электрода, то этот процесс (электролиз) широко используют для покрытия каких-либо изделий тонким слоем металла, т.е. никелируют, хромируют и т.д. Электрический ток в растворах течет и внутри гальванических элементов, и внутри аккумуляторов.
Вопросы
Какие жидкости называются электролитами?
2. Дистиллированная вода не является проводником. Почему?
Что такое электролиз?
Как влияет температура на перенос вещества при электролизе?
Сформулируйте законы Фарадея для электролиза.
Каков физический смысл электрохимического эквивалента? Запишите формулу.
Почему вокруг электролита нет электрического поля, хотя внутри есть заряженные ионы?
Цель работы: научиться опытным путем определять электрохимический эквивалент вещества
Оборудование: медные электроды со вставкой – 2 шт., электролитическая ванна с раствором медного купороса, амперметр, реостат, источник постоянного тока, колюч, соединительные провода, весы с разновесами.
Теория: сформулировать первый закон Фарадея для электролиза;
дать определение электрохимическому эквиваленту вещества, записать формулу и единицы измерения.
Ход работы
Зачистив наждачной бумагой медную пластину, которая будет являться катодом, взвешиванием определить массу пластины с точностью до 0,01г.
С
 обрать
электрическую цепь по схеме. При
составлении цепи обратить внимание,
что взвешенная
пластина (электрод) соединяется с
отрицательным полюсом источника
электрической энергии.
обрать
электрическую цепь по схеме. При
составлении цепи обратить внимание,
что взвешенная
пластина (электрод) соединяется с
отрицательным полюсом источника
электрической энергии.
Замкнуть электрическую цепь и зафиксировать время.
При помощи реостата, в течении всей работы, поддерживать постоянную величину силы тока в пределах от 0,5 А до 1 А.
Через 15 – 20 минут разомкнуть цепь и, вынув катодную пластину, просушить ее.
Взвешиванием определить массу катода с точностью до 0,01 г.
Найти массу меди, выделившейся на катоде при электролизе с точностью до 0,01 г.
По результатам измерений, используя первый закон Фарадея для электролиза, определить электрохимический эквивалент меди.
Результаты всех измерений и вычислений записать в таблицу.
№ п/п |
Масса отложившейся меди на катоде, m, кг |
Время пропускания электрического тока, t, с |
Сила тока, I, А |
Электрохимический эквивалент, k,
|
Относительная погрешность, δ, % |
|
|
|
|
|
|
Определить абсолютную и относительную погрешность измерений по табличному значению. Записать ответ.
Ответить на контрольные вопросы:
Нужно ли опыт проделывать снова, если электролитическая ванна была включена так, что взвешенная пластина оказалась анодом? Как следует поступить в этом случае?
Привести примеры использования электролиза с целью улучшения качества оборудования предприятий общественного питания или товаров народного потребления.
Тест
В основе получения чистой меди лежит явление:
а) электролитическая диссоциация;
б) электролиз;
в) проводимость электролитов.
2. Электрический ток в электролитах – направленное движение:
а) электронов;
б) молекул и ионов;
в) ионов и электронов:
г) положительных и отрицательных ионов.
3. Чистая вода является диэлектриком. Водный раствор соли NaСl является проводником, т.к. :
а) соль в воде распадается на заряженные ионы Na+ и Cl-;
б) после растворения соли молекулы NaСl переносят заряды;
в) в растворе от молекулы NaСl отрываются электроны и переносят заряд;
г) при взаимодействии с солью молекулы воды распадаются на ионы водорода и кислорода;
д) при растворении вода нагревается и ионизируется.
4. При пропускании через водный раствор хлористого водорода (HCl) тока силой 100 мА в течение 16 с выделяется куоличе5ство молекул водорода (H2):
а) 1022;
б) 5∙1021;
в) 1019;
г) 5∙1018;
д) 1,6∙1019.
5. Определите массу серебра, выделившего на катоде при электролизе азотнокислого серебра за 2 ч, если напряжение между анодом и катодом 12 В, а сопротивление раствора 5 Ом (k = 1,118·10 – 6 кг/Кл).
А. 0,32·10 – 2 кг.
В. 32·10 – 2 кг.
В. 0,32·10 – 3 кг.
Г. 32·10 – 3 кг.
Лабораторная работа № 12
Исследование электрических свойств полупроводников
Теоретическая часть
Полупроводники, их собственная проводимость. Понятие дырки.
В отличие от металлов в кристаллах полупроводников (кремний, германий) при нормальных условиях число электронов проводимости мало. При повышении температуры валентные электроны в полупроводниковых материалах могут электронами проводимости.
В идеальном кристалле все атомы электронейтральны и попарно связаны друг с другом валентными электронами. Тепловое движение, приводящее к появлению электронов проводимости, разрывает связь, удаляя один из электронов от места его локализации, образуется дырка, т.е. пара атомов с нарушенной связью, обладающая положительным зарядом, которая может захватить валентные электроны у соседних атомов. Так как все атомы одного элемента совершенно одинаковы, то этот процесс эквивалентен перемещению по кристаллу нарушенной связи (вакансии), т.е. дырки. В чистом полупроводнике количество электронов проводимости равно количеству дырок. Проводимость чистого полупроводника является электронно-дырочной, т.е. в равной степени обеспечивается движением электронов проводимости и валентных электронов, которые перескакивают на вакансии (что эквивалентно перемещению дырок).
Любые другие внешние воздействия, например облучение светом или механическое воздействие, а также внешнее электрическое поле, также изменяют энергию электронов в полупроводнике и приводят к существенному изменению числа носителей. Эти свойства полупроводников широко используются в технике.

Рис. 1
Простейшими техническими устройствами на основе полупроводников являются терморезисторы и фоторезисторы. Терморезисторы могут использоваться в противопожарной сигнализации, в качестве измерителей температуры и др. Фоторезисторы могут быть фотодатчиками самого разного предназначения: измерителем мутности (рис. 1), реле для включения освещения улиц, автоматом турникета метро и т.д.
