
Лекция №5 Генетика индивидуального развития
Активность генов на разных этапах онтогенеза.
Взаимодействие ядра и цитоплазмы.
Влияние гена на развитие признака.
Проявление генотипа в разных условиях внешней среды.
Критические периоды развития.
Литература:
- Ветеринарная генетика / В.Л. Петухов, А.И. Жигачев, Г.А. Назарова // 2-е изд., перераб. и доп. - М.: Колос, 1996. – С. 178-195;
Активность генов на разных этапах онтогенеза.
Онтогенез – индивидуальное развитие организма от оплодотворения яйцеклетки и до смерти.
Онтогенез – непрерывный процесс количественных и качественных изменений, происходящих в организме в течение всей жизни при постоянном взаимодействии генотипа и условий среды.
Филогенез – историческое развитие вида, эволюционное развитие организмов.
Онтогенез включает два основных взаимосвязанных процесса роста и развития.
Рост – это процесс увеличения размеров организма, его массы, происходящий за счет накопления в нем активных (главным образом) белковых веществ. В его основе лежит увеличение числа и размеров клеток и неклеточных образований.
Развитие – это качественные изменения – процессы усложнения структуры организма: специализация, дифференциация и интеграция его органов и тканей.
ТИПЫ ОНТОГЕНЕЗА
|
||||||||
Прямое развитие |
|
Непрямое развитие (с метаморфозом) |
||||||
Внутриутробное развитие (млекопитающие) |
Откладка яиц (птицы) |
|
|
с неполным метаморфозом (яйцо-личинка-взрослая особь) |
|
С полным метаморфозом (яйцо-личинка-куколка-взрослая особь) |
|
|
ПЕРИОДЫ ОНТОГЕНЕЗА
|
|||||||
Эмбриональный (пренатальный) |
|
Постэмбриональный (постнатальный) |
|||||
От рождения или выхода из яйца
|
|
|
|
|
|
|
|
Онтогенез каждой особи подчиняется биогенетическому закону Мюллера-Геккеля: сходство эмбриональных черт развития отражает степень родства разных форм в силу общности их происхождения или индивидуальное развитие особи (онтогенез) до определённой степени повторяет историческое развитие вида (филогенез), к которому относится данная особь.
Процесс дробления зиготы у всех многоклеточных животных организмов проходит начальные стадии эмбриогенеза – бластулу и гаструлу. Для позвоночных характерно прохождение стадии, на которой у наземных форм, дышащих легкими, образуются жаберные дуги, как и у рыб.
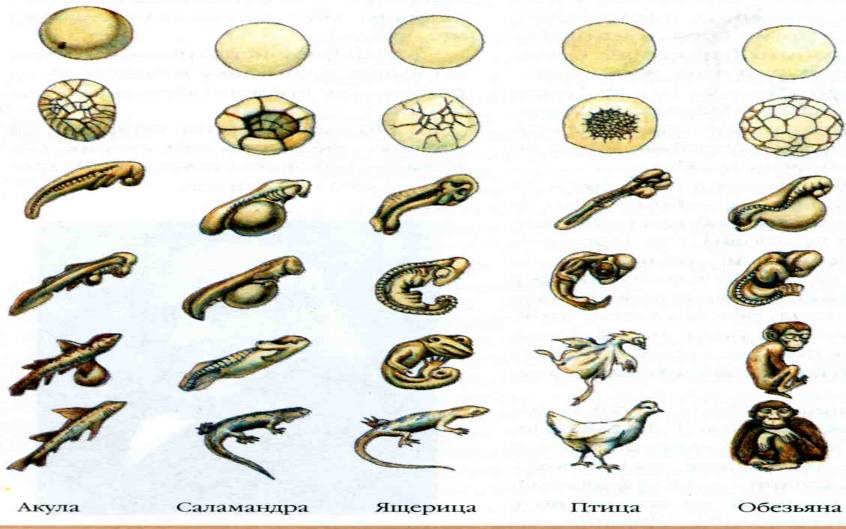
Также эмбриогенез характеризуется неравномерностью и неодновременностью процессов роста и дифференцировки.
В эмбриональной ткани животных клетки относительно одинаковы по форме и составу белков. Позже эмбриональная клетка превращается в клетки с различной специализацией.
Такое проявление различий между клетками называют дифференцировкой. В период дифференцировки активно функционируют гены, контролирующие синтез специфических белков, необходимых для формообразовательных процессов и интеграции специализированных клеток.
Итак, онтогенез начинается с акта оплодотворения. У животных в яйцеклетке до оплодотворения накапливается большое количество всех типов РНК: м-РНК, р-РНК и т-РНК, - которые до оплодотворения находятся в неактивном состоянии. Они соединяются со специфическими белками и образуют неактивные гранулы информосомы. Через несколько минут после оплодотворения часть молекул м-РНК информосом освобождаются от белка, поступают на рибосомы цитоплазмы яйцеклетки и начинается синтез определенных белков, необходимых для начального развития зиготы. Начальный период развития зиготы осуществляется под контролем генов материнского организма: м-РНК яйцеклетки обеспечивает синтез белков до стадии поздней бластулы. С начала стадии гаструляции и в дальнейшем синтез белка осуществляется под влиянием м-РНК, образующейся в ядрах клеток эмбриона,т.е. под контролем генов обеих родительских особей.
А.А. Нейфах (1976) изучал первые стадии развития зародышей рыбки вьюна. Он, обрабатывал оплодотворенные яйца лучами рентгена. Дозы облучения были подобраны таким образом, чтобы прекратить деятельность ядра и нейтрализовать гены в молекулах ДНК. При облучении яиц сразу после оплодотворения или зародыша на стадии ранней бластулы развитие его шло нормально до поздней бластулы, а затем прекращалось, и наступала гибель. Следовательно, развитие эмбриона в этот период определяется и РНК, находящейся в цитоплазме клеток бластулы, т.е. это материнская РНК обеспечивает на ранней стадии дробления зигот и бластулы синтез белка. Развитие эмбриона прекращается на стадии гаструлы, т.к. для начала онтогенеза нужны белки, синтез которых кодируется ядерными генами, локализованными в хромосомах материнской и отцовской особей.
При облучении эмбрионов в период гаструляции, перед началом органогенеза и даже в период поздней бластулы развитие не прекращалось сразу после облучения.
Таким образом, ядро зиготы, образовавшееся в результате слияния материнского и отцовского ядер и объединения их генетической информации, в начальный период развития зародыша не оказывает влияния на дробление зиготы и образование бластулы. Эмбрион в этот период развивается за счет РНК и других компонентов, находящихся в цитоплазме молекулы.
О неоднородности активности различных генов может свидетельствовать изменение состава белков организма в связи с возрастом. На стадиях раннего эмбрионального развития у человека идет образование гемоглобина F, который состоит из двух полипептидов – альфа и гамма. Приблизительно с 13 недели эмбрионального развития начинается синтез Hg A, характерного для взрослого человека ( у Hg A цепь полипептиды гамма замена на цепь бета несколько другого строения) Цепь альфа у обоих гемоглобинов одинакова, и ее синтез контролируется одни и тем же геном. У новорожденного HgF составляет 70-80 процентов общего количества. И только к году происходит полная замена HgF HgA. По данным некоторых отечественных ученых у телят полная замена HgF HgA происходит к 110-120-дневному возрасту.
Для понимания активности генов важно знать его структуру от которой зависит и его действие.
Так, к концу 20-х годов двадцатого века сложилось представление о гене как материальной частице, лежащей в хромосоме, способной к саморепродукции и являющейся минимальной единицей рекомбинации, мутирования и генетической функции. Цепочка сцепленных генов представлялась как нитка корпускул или бусинок, механически связанных друг с другом. Ген, согласно этим представлениям, считался неделимым с помощью кроссинговера. Нормальному аллелю противопоставлялся мутантный.
В 1929 г. А.С. Серебровский и Н.П. Дубинин описали серию индуцированных мутаций гена scute (sc), нарушающих формирование разных щетинок у дрозофилы (Рис. 7.1.). Было выявлено 14 мутаций гена: SC1, SC2 и т.д., при которых получены особи частично лишенные щетинок на определенных участках или имеющие редуцированные щетинки или прочее.
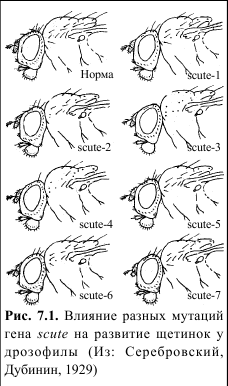
У гетерозиготных потомков не развивались только те щетинки, которые, которых не было у обоих родителей. Щетинки развивались нормально, если изменение наблюдалось только в одном из аллельных генов. Если, например, мутация SC1 вызывала редукцию щетинок АВС, а мутация SC2 – редукцию щетинок ВСD, то у гетерозиготы отсутствовали щетинки В и С и развивались нормально А и D.
Авторы назвали ген scute базигеном, т.е. участком хромосомы, занимаемым всеми изменениями - трансгенами scute. Самостоятельные при трансгенациях (мутациях) элементарные участки внутри базигена были названы центрами. Мутации могут захватывать как отдельные центры, так и целые их группы. При этом аллели расположены ступенчато.
ЦЕНТРОВАЯ ТЕОРИЯ ГЕНА – ген состоит из отдельных функциональных участков - центров, которые могут независимо изменяться при мутациях.
Много позже М. Грин и К. Грин (1949) показали делимость гена lz у дрозофилы посредством кроссинговера. Они получили гетерозигот, 0,1% потомков от которых обнаруживали либо нормальные глаза, либо более сильное мутантное проявление, чем любой из аллелей. Это могло произойти только в результате кроссинговера внутри этого гена. Чтобы спасти представление о неделимости гена, такие аллели стали называть ПСЕВДОАЛЛЕЛЯМИ.
Позже У. Яновский показал, что кроссинговер происходит между любой парой нуклеотидов. Эта пара была названа РЕКОНОМ.
ПЕРЕКРЫВАЮЩИЕСЯ ГЕНЫ У ВИРУСОВ И ПРОКАРИОТ
Генетический материал мелкого бактериофага φX174 представлен одноцепочечной ДНК и состоит всего из 9 генов, продукты которых хорошо изучены. ДНК, необходимая для кодирования этих продуктов, должна бы состоять минимум из 6078 нуклеотидов. На самом же деле хромосома фага φX174 состоит из 5374 нуклеотидов. Этот парадокс удалось разрешить лишь после того, как в 1978 г. группой Ф. Сэнгера было проведено полное секвенирование ДНК этого фага. Оказалось, что кодирующие последовательности двух генов (B и E) локализованы внутри кодирующих последовательностей двух других генов (А и D). При этом рамка считывания (т.е. триплет, прочитываемый при трансляции) в каждом случае оказывалась сдвинутой на одну пару нуклеотидов. Например, в определённом участке внутри гена D, находится последовательность, GTTTATGGTACG которая в полипептиде D, кодирует последовательность валин-тирозин-глицин-треонин. Рамка считывания гена E- смещена вправо на один нуклеотид от рамки считывания гена D,. Поэтому триплет ATG распознается РНК-полимеразой как стартовый и в полипептиде E – появляется формилметионин, за которым последует валин, кодируемый триплетом GTA, и т.д.
Сходным
образом кодирующая последовательность
гена B
оказывается внутри кодирующей
последовательности гена A.
В результате сдвига рамки считывания
кодируемые перекрывающимися генами
полипептиды полностью отличаются друг
от друга по последовательностям
аминокислот.

Геном бактериофага φX 174, паразитирующего на бактерии Escherichia coli (кишечной палочке), — пример экономного использования носителей генетической информации. Обратите внимание на то, что ген b находится внутри гена a, а ген e перекрывает часть гена d. Генетический код на одном и том же участке генетического материала считывается в разных фазах,т. е. со сдвигом на один или два нуклеотида. В результате на одном и том же участке генетического материала можно закодировать два разных белка(по: Ф. Айала, Дж. Кайгер, 1988)
Подобная ситуация “ген внутри гена” обнаружена и в ряде других случаев. Частично перекрывающиеся кодирующие последовательности обнаружены в ДНК вируса млекопитающих SV40. У РНКового фага MS2 один из генов перекрывает два других и, следовательно, не перекрывается лишь один из фаговых генов.
П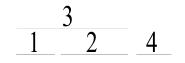 ри
анализе одного из мобильных генетических
элементов у бактерий - элемента IS5 - был
обнаружен еще более яркий пример
сверхкомпактной организации генетической
информации. В этом случае одна из цепей
дуплекса ДНК содержит два перекрывающихся
гена, а комплементарный им участок
второй цепи образует третий ген.
Следовательно, обе цепи значимы и несут
информацию, соответствующую трем генам.
ри
анализе одного из мобильных генетических
элементов у бактерий - элемента IS5 - был
обнаружен еще более яркий пример
сверхкомпактной организации генетической
информации. В этом случае одна из цепей
дуплекса ДНК содержит два перекрывающихся
гена, а комплементарный им участок
второй цепи образует третий ген.
Следовательно, обе цепи значимы и несут
информацию, соответствующую трем генам.
ОПЕРОННЫЙ ПРИНЦИП ОРГАНИЗАЦИИ ГЕНОВ У ПРОКАРИОТ
Бактериям необходимо уметь быстро отвечать на изменения в окружающей среде. Их выживаемость зависит от способности переключать метаболизм с одного субстрата на другой, поскольку поступление питательных веществ может постоянно меняться.
Бактерия не синтезирует ферментов того или иного метаболического пути в отсутствие соответствующего субстрата, но способна в любое время начать их синтез при появлении такового. Для осуществления подобного реагирования гены бактерий объединены в кластеры таким образом, что ферменты, необходимые для осуществления определенного пути биосинтеза, кодируются генами, сцепленными друг с другом.
Гены можно поделить на две группы по принципу действия их продукта. Гены, которые кодируют белки, необходимые для ферментативных или структурных функций, называются структурными. Большинство генов бактерий попадают в эту категорию, которая, таким образом, представлена огромным разнообразием функций и структур белков.
Гены, кодирующие белки, которые регулируют экспрессию других генов, называются регуляторными. Поскольку продукты регуляторных генов свободно диффундируют и находят подходящие мишени для активирования, такой тип взаимодействий генов называют транс-регуляцией.
Транс-действующий белок может регулировать ген-мишень либо позитивно, если в результате взаимодействия регулируемый ген включается, или негативно, если он выключается. Белок-регулятор связывается с цис-регулирующей последовательностью регулируемого гена, которая располагается обычно (но не исключительно) выше гена-мишени.
Структурные гены бактерий имеют тенденцию быть организованными в кластеры генов кодирующих белки, чьи функции связаны.
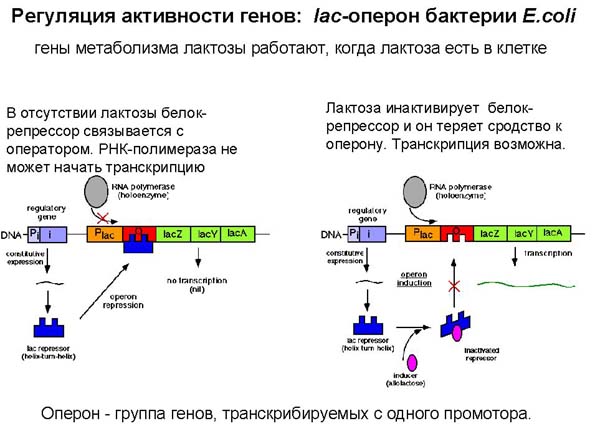
Примером кластерной организации у E. coli являются лактозные гены, которые индуцируются и репрессируются под действием субстрата.
Весь кластер генов занимает около 6000 п.н. (Рис. 7.3.). Ген lacI имеет свой промотор и терминатор. Конец района lacI непосредственно примыкает к промотору lac(P), оператор lac(O) занимает первые 26 п.н. гена lacZ. После гена lacZ, который имеет необычно большую длину, расположены гены lacY и lacA, а также общий терминатор транскрипции.
Гены имеют следующие функции: продукт lacZ расщепляет бета-галактозид на составляющие его сахара, например, лактозу на глюкозу и галактозу, продукт гена lacY является бета-галактозид пермеазой, он транспортирует бета-галактозид в клетку. Ген lacА кодирует белок трансацетилазу, энзим, который переносит ацетильную группу с ацетил-СоА на бета-галактозид.
Вся эта система, включающая структурные гены и элементы, контролирующие их экспрессию, формирует общую единицу регуляции, называемую опероном. Модель оперона была предложена в 1961 году Ф. Жакобом и Ж. Моно. В короткое время эта модель стала в центре внимания не только генетиков, но и огромного числа биологов во всём мире. Она позволила увидеть реальный механизм регуляции активности генов (см. Brenner, 1997).
Механизмы регуляции у эукариот значительно сложнее и менее изучены. Это связано со сложной дифференцировкой клеток разных органов и тканей. У эукариот выявлены гены, проявляющие активность во всех клетках организма и гены, действие которых проявляется только в специализированных тканях.
У эукариот возможно одновременное групповое подавление активности генов: во всем ядре, в целой хромосоме или в большом ее участке. Предполагается, что такая репрессия генов осуществляется в значительной мере с помощью гистоновых белков. Групповое выключение активности генов в одной из Х-хромосом наблюдается в онтогенезе у самок млекопитающих, обладающих двумя Х-хромосомами. В этих хромосомах находятся гены, детерминирующие дифференцировку пола на ранних стадиях онтогенеза. Затем одна из Х-хромосом инактивируется, превращаясь в так называемое тельце Бара. Этим достигается сбалансированность эффекта генов из Х-хромосомы у самок и самцов.
Рассмотренные выше данные несомненно свидетельствуют о том, что развитие - это процесс последовательного включения все более и более усложняющихся генных систем. При этом продукты одних генов находят специальные посадочные площадки в регуляторных районах других генов, садятся на них и включают эти гены в активное функционирование. И так – сплошная последовательность включений и выключений генов.
