
- •2 Экспериментальная часть
- •2.1 Исходные вещества, методики эксперимента, исследований и анализа
- •2.1.2 Методики анализа
- •2.2 Исследование экстракция кадмия нбэа-2 из сульфатных растворов
- •2.2.1 Изучение влияния времени контактирования фаз на экстракцию кадмия
- •2.2.2 Влияние рН водной фазы на экстракцию кадмия
- •2.3 Определение состава экстрагируемого комплекса
- •2.4 Изучение процесса реэкстракции кадмия
2.3 Определение состава экстрагируемого комплекса
Для определения состава экстрагируемого комплекса кадмия был использован метод сдвига равновесия.
В основе метода сдвига равновесия (метод тангенса угла наклона) лежит зависимость коэффициента распределения кадмия (18) от концентраций экстрагента, при постоянстве всех других параметров.
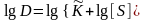 (18),
(18),
где
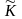 - концентрационная константа равновесия,
S – равновесная концентрация экстрагента.
- концентрационная константа равновесия,
S – равновесная концентрация экстрагента.
Данный метод можно использовать только при экстракции из разбавленных растворов, когда можно принять, что коэффициенты активностей компонентов равны единице и постоянны, т.е. активности компонентов равны их концентрациям. Кроме того, в изучаемой системе концентрация экстрагента должна быть намного больше концентрации извлекаемого металла, тогда можно будет принять, что исходная концентрация экстрагента равна его равновесной концентрации [Казаринов И.А. Физико-химические свойства и электрохимическое поведение гидроксида кадмия. Дисс. На соискание уч. ст. к.х.н. Саратовский гос. ун-т, 1980, Саратов, 18 с.].
Была изучена экстракция кадмия раствором НБЭА-2 в керосине + 25 % октанола, с концентрацией в диапазоне от 0,05 до 0,5 моль/л. Исходный раствор содержал 0,96 г/л кадмия при рНconst.- 8,30. Полученные данные приведены в табл. 7 и в виде зависимости lg DCd от lg Cравн., на рис. 14.
Таблица 7
Влияние концентрации экстрагента на извлечение кадмия.
СНБЭА-2 моль/л |
ХCd, моль/л |
YCd, моль/л |
DCd |
lоgDCd |
lоgСравн |
0,05 |
0,0085 |
0,0001 |
0,012 |
-1,92 |
-1,3 |
0,1 |
0,0084 |
0,0002 |
0,024 |
-1,62 |
-1 |
0,28 |
0,0081 |
0,0005 |
0,062 |
-1,2 |
-0,55 |
0,39 |
0,0059 |
0,0027 |
0,46 |
-0,34 |
-0,41 |
0,5 |
0,0048 |
0,0038 |
0,79 |
-0,1 |
-0,3 |

Рис.14 Билогарифмическая зависимость коэффициента распределения кадмия от концентрации НБЭА-2.
Как видно из представленных данных, по мере роста концентрации экстрагента, коэффициент распределения кадмия возрастает. Тангенс угла наклона зависимости lg DCd = f (lg Cравн.) оказался близок к двум (tga=1,76), то есть соотношение металл-реагент в экстрагируемом комплексе равно 1 : 2.
Основываясь на полученных и литературных данных по экстракции кадмия азотсодержащими экстрагентами было предположено, что экстрагент НБЭА – 2 экстрагирует кадмий за счет образования хелата по следующему уравнению:
2RH + Сd(OH)+ → R2Cd + H2O + H+ ()
2.4 Изучение процесса реэкстракции кадмия
Реэкстракция является неотъемлемой частью экстракции. Поэтому нами была изучена реэкстракция кадмия серной кислотой. Концентрацию H2SO4 изменяли в диапазоне от 0,5 до 2 М. Реэкстракцию кадмия проводили из органической фазы, содержащей 1 г/л металла. Полученные результаты представлены в табл. 10 и на рис. 17.
Таблица 10
Влияние концентрации серной кислоты на реэкстракцию кадмия
№ |
СH2SO4, M |
YCd, г/л |
XCd, г/л |
ECd, % |
1 |
0,5 |
0,05 |
0,95 |
95 |
2 |
1 |
0,03 |
0,97 |
97 |
3 |
1,5 |
0,005 |
0,995 |
99,5 |
4 |
2 |
0,005 |
0,995 |
99,5 |
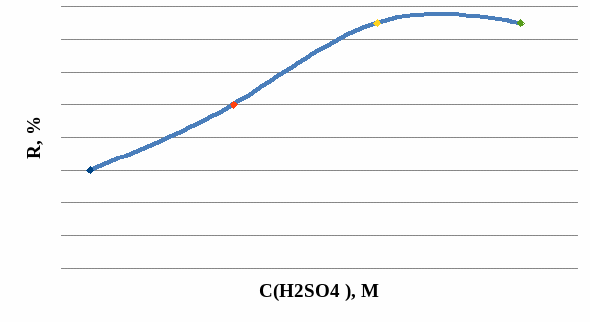
Рис. 17. Влияние концентрации H2SO4 на реэкстракцию кадмия.
Из полученных данных видно, что по мере увеличения концентрации серной кислоты, степень извлечения кадмия из органической фазы возрастает и достигается практически полная реэкстракция металла при концентрации серной кислоты 1,5 М H2SO4.
Для определения условий равновесия при реэкстракции кадмия, было изучено влияние времени контактирования объемов фаз на реэкстракцию кадмия. Полученные результаты представлены в табл. 11 и на рис. 18:
Таблица 11
Влияние времени контактирования водной и органической фаз на реэкстракцию кадмия
№ |
τ, мин |
YCd, г/л |
XCd, г/л |
ECd, % |
1 |
5 |
0,005 |
0,995 |
99,5 |
2 |
10 |
0,005 |
0,995 |
99,5 |
3 |
15 |
0,005 |
0,995 |
99,5 |
4 |
30 |
0,005 |
0,995 |
99,5 |
5 |
60 |
0,005 |
0,995 |
99,5 |
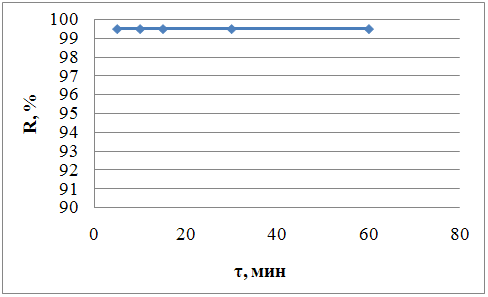
Рис.18 Влияние времени контакта фаз на реэкстракцию кадмия
Из полученных данных видно, что равновесие на стадии реэкстракции устанавливается очень быстро, достаточно проводить перемешивание фаз всего лишь в течение 5 минут.
