
34. Термодинамиканың 1-ші заңы.
Жүйенің сіңірген жылуы оның ішкі энергиясын өзгертуге және сыртқы күштерге қарсы жұмыс нұсқау үшін қолданады.
35.Гесс заңы: Химиялық реакцияның жылу эфектісі бастапқы заттар мен өнімдердің түріне және күйіне байланысты болады, бірақ реакцияның жүріп өткен тәуелді болмайды.
ΔH=Hө-Hb
37. 1 cалдар: Химиялық реакциялардың энтальпия өзгерісі түзілген өнімдер мен реакцияға түскен бастапқы заттардың түзілу жылуларының қосындыларының айырмасына тең.
Заттың түзілу жылуы – химиялық таза күрделі заттың бір молі қарапайым заттардың стандартты жағадйда түзілгенде анықталатын энтальпия өзгерісі. (kДж/моль)
Заттардың жану жылуы- химиялық таза органикалық күрделі заттың бір молі стандартты жағадайда жанғанда анықталатын энтальпия өзгерісі. (кДж/моль)
2 салдар: Органикалық заттыңтүзілу жылуы тең осы заттың түзетің қарапайым заттардың жану жылуларының қосындысы- осы күрделі заттың өзінің жану жылуы.
Химиялық реакцияның жылу эфектісі деп оның тұрақты қысымда не тұрақты көлемде бөліп шығаратын немесе сіңіретін энергияның мөлшерін айтады.
38. Термодинамиканың екінші заңы энтропия мен байланысты. Екінші заң былай айтылады: Жылу мөлшері Q жүйеге Т температурада қайтымды процесс арқылы сіңірілсе, жүйенің энтропиясы S мынау шамаға тең болады.
ΔS=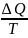
Барлық өз бетінше жүретін процесстер 2 фактормен сипатталады.
-Жүйе минимум энергияға ұмтылады
-Жүйе максимум ретсіздікке ұмтылады.
Ретсіздік дәрежесә энтропия (S), Дж/моль*К
ΔSx.p.=ΣΔSөнім-ΣΔSбасты
ΔS>0 болса, процесс өз бетінше жүреді.
ΔS<0 болса, процес өз бетінше жүрмейді.
39. Гибсс энергиясы, энтальпия Н, энтропия S және температура бір-бірімен мынадай байланыста: ΔG=ΔH-TΔS
Ал осы теңдеуден ΔН және Т*ΔS мәндеріне байланысты Гибсс энергиясы танбасының мәнін білуге болады. Осыған орай химиялық реакция бағыты да анықталады. Егер қысым және температура тұрақты болса, ΔG<0 болған жағдайда реакция тур бағытта өздігінен жүре алады.
40. Гибсс энергиясының өзгерісі.
P=const Гибсс энергиясы немесе изобаралы-изотермиялық потенциал. (G)
ΔG=ΔH-TΔS (P.T=const)
Кез келген өз бетінше жүретін химиялық процесс жүйеде Гибсс энергиясы төмендейтін
(P.T=const) бағытта жүреді. Процестің жүру жағдайын ΔG<0 шамасы көрсетеді, яғни ΔG өзгерісі теріс мән болу керек. Егер ΔG процессте төмендесе, процесс жүруі мүмкін және әрі қарай өз бетінше жүреді. Керісінше ΔG мәні жоғарыласа, берілген жағдайларда реакцияның іске аспайтындығын көрсетеді ΔG>0.
