
- •1.Классификация органических соединений-
- •Формулы органических веществ по классам:
- •5. Применение алканов
- •6. Классификация непредельных углеводородов.
- •7. Номенклатура непредельных углеводородов.
- •13. Классификация спиртов.
- •14. Общая характеристика спиртов (определение, гомологический ряд).
- •19. Применение спиртов.
- •25. Реакция полимеризации.
- •28. Физико-химические свойства карбоновых кислот.
- •29. Номенклатура карбоновых кислот.
- •30. Качественные реакции на альдегидную группу.
- •46.Классификация солей
- •47.Номенклатура оксидов
- •48.Номенклатура кислот
- •63. Краткая характеристика металлов.
- •Строение атомов неметаллов
- •56.Метод ионный баланс
29. Номенклатура карбоновых кислот.
По международной номенклатуре ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание "овая" и слово "кислота". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота. По рациональной номенклатуре к названию углеводорода добавляют окончание "карбоновая" и слово "кислота", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет-бутилкарбоновая кислота. Многие из карбоновых кислот имеют тривиальные названия.
30. Качественные реакции на альдегидную группу.
Одна
из самых интересных качественных реакций
в органической химии — на альдегиды,
предназначена исключительно для
выявления соединений, содержащих
альдегидную группу. К альдегиду приливают
аммиачный раствор оксида серебра,
реакция идет при нагревании:
CH3-CHO
+ 2[Ag(NH3)2]OH
—t—> CH3-COOH
+ 2Ag↓ + 4NH3↑
+ H2O
Если
опыт проведен грамотно, то выделяющееся
серебро покрывает колбу ровным слоем,
создавая эффект зеркала. Именно поэтому
реакция называется реакцией
серебряного зеркала.
Примечание:
реакцией серебряного зеркала также
можно выявить метановую (муравьиную)
кислоту HCOOH. При чем тут кислота, если
мы говорим про альдегиды? Все просто:
муравьиная кислота — единственная из
карбоновых кислот, содержащая одновременно
альдегидную и карбоксильную группы:
![]()
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду: HCOOH + 2[Ag(NH3)2]OH —t—> CO2↑ + 2H2O + 4NH3↑ + 2Ag↓ Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь: CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2↓ CH3-CHO + 2Cu(OH)2 —t—> CH3-COOH + Cu2O↓ + 2H2O Выпадает оксид меди (I) Cu2O — осадок красного цвета.
Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера: CH3-CHO + K2[HgI4] + 3KOH ——> CH3-COOK + Hg↓ + 4KI + 2H2O
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
31. Простые эфиры (характеристика).
ростые эфиры представляют собой органические вещества, в которых молекулы содержат углеводородные радикалы, соединенные атомом кислорода. Записать это можно следующим образом: R'–O–R", где R" и R' являются одинаковыми или различными радикалами. Простые эфиры рассматриваются в качестве производных спиртов. Эти соединения имеют составные названия. При этом используется название радикалов (по возрастанию молекулярной массы) и, собственно, слово "эфир" (диметиловый эфир СН3ОСН3, метилэтиловый эфир С2Н5ОСН3.
32 Сложные эфиры. Реакция этерификации.
Эфиры сложные, органические соединения, производные кислот, в молекулах которых гидроксильная группа OH замещена на остаток спирта, енола или фенола — OR,.. Э. с. являются структурными аналогами солей кислородных кислот: вместо атома металла в Э. с. находится углеводородный радикал R. Отсюда и сходная номенклатура, например натрия ацетат NaOCOCH3 иэтилацетат C2H5OCOCH3. Подобно солям, Э. с. образуют с двух- и многоосновными кислотами продукты неполного и полного замещения: соответственно кислые эфиры, например монометилсульфат HOSO2OCH3, и полные, или средние, эфиры, например диметилсульфат CH3OSO2OCH3. Однако по свойствам Э. с. существенно отличаются от солей; это типичные органические соединения: обычно жидкие летучие вещества, в некоторых случаях обладающие фруктовым или цветочным запахом, практически нерастворимые в воде, хорошо растворимые в органических растворителях. Под действием воды Э. с. подвергаются гидролизу с образованием соответствующих спирта и кислоты, например RCOOR' + H20 Û RCOOH + HOR’. Эта реакция ускоряется кислотами и ещё эффективнее — щелочами. В последнем случае образуются не свободные кислоты, а их соли и реакция становится необратимой. Из других реакций, в которых Э. с. проявляют ацилирующие свойства, наиболее известны переэтерификация, алкоголиз, реакции двойного обмена. Некоторые Э. с., например образованные низшими алифатическими спиртами и такими кислотами, как серная, трифторуксусная, фосфорная, фталевая, обладают также алкилирующими свойствами (см. Алкилирование, Диметилсульфат, Этилсерная кислота). Получают Э. с., как правило,этерификацией, а также ацилированием спиртов различными производными кислот (галогенангидридами, ангидридами), действием солей кислот на алкилгалогениды
Этерификация— реакция образования сложных эфиров при взаимодействии кислот и спиртов:
RCOOH + R’OH ⇔ RCOOR' + Н2О
Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированного карбкатиона
Этерификацию обычно проводят в присутствии катализаторов — сильных кислот (серная кислота, толуолсульфоновая кислота и т. п.).
Реакция этерификации обратима (гидролиз сложных эфиров называется омылением), положение равновесия зависит от строения и концентраций спирта и карбоновой кислоты, то есть для реакционной смеси существует предел этерификации, при котором устанавливается равновесие, характеризующееся определенным соотношением концентраций исходных спирта и кислоты и продукта их реакции — сложного эфира. Так, например, при эквимолярном соотношении этанола и уксусной кислоты в исходной реакционной смеси равновесие устанавливается, когда ~2/3 спирта и кислоты прореагируют с образованием этилацетата.
Для повышения выхода сложного эфира используют либо избыток одного из реагентов (обычно спирта), либо отгонку образующейся при этерификации воды в видеазеотропной смеси с добавляемым в реакционную смесь бензолом.
33. Твердые жиры.
Жиры-это сложные эфиры образованные глицирином и высшим карбоновыми кислотами.
В состав твёрдых жиров- входят триглицириды с остатками предельных кислот …они представляют собой твёрдые жиры (животные жиры)
34. Жидкие жиры.
Жиры-это сложные эфиры образованные глицирином и высшим карбоновыми кислотами.
В состав жидких жиров- входят остатки непредельных карбоновых кислот (сливочное масло в исключении) их называют маслами и относят к растительным жирам.
Жидкие жиры подвергаются отверждения или гидродинизации- это взоимодействие непредельный остатков карбоновых кислот с водородом при этом кратные связи рвутся и переходят в непредельные продукты (Сало-масло)
35.Реакция Омыления
Омыление — это расщепление сложного эфира с образованием спирта и соли (или органической кислоты). При омылении жиров, представляющих собой эфиры высших жирных кислот и глицерина, щелочами образуются соли жирных кислот, называемые мылами (отсюда и происхождение термина «омыление»).
Реакция омыления обратна реакции этерификации — образованию сложного эфира из спирта и кислоты. При О. разрывается связь между атомом кислорода эфира и атомом углерода карбонильной группы. В промышленности широко используют О. природных жиров щелочами при повышенной температуре, в результате которого образуются соли высокомолекулярных жирных кислот — мыла (отсюда и название О.). Омыление сложных эфиров имеет большое значение в биологическом обмене веществ. Оно происходит под действием соответствующих ферментов — эстераз.
36. Отверждение жиров. Сало-масла.
Жидкие жиры подвергаются отверждения или гидродинизации- это взоимодействие непредельный остатков карбоновых кислот с водородом при этом кратные связи рвутся и переходят в непредельные продукты (Сало-масла)
37.Виды гибридизации
Внутривидовая-скрещивание происходит между одним и тем же видом
,Межвидовое скрещивание- скрещивание просхидит между разными видами,сортами.
38.Понятие гибридизация
Гибридизация — процесс образования или получения гибридов, в основе которого лежит объединение генетического материала разных клеток в одной клетке.
39.Электронное строение атома
Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами ядра (линейные размеры атома ~ 10~8см, его ядра ~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значительной степени условны и зависят от способов их определения. Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами. Положит. заряд протона и отрицат. заряд электрона одинаковы по абсолютной величине и равны е= 1,60*10-19 Кл; нейтрон не обладает электрическим зарядом. Заряд ядра +Ze - основная характеристика атома, обусловливающая его принадлежность к определенному химическому элементу. Порядковый номер элемента в периодической системе Менделеева (атомный номер) равен числу протонов в ядре.
40. Электронная схема строения атома.
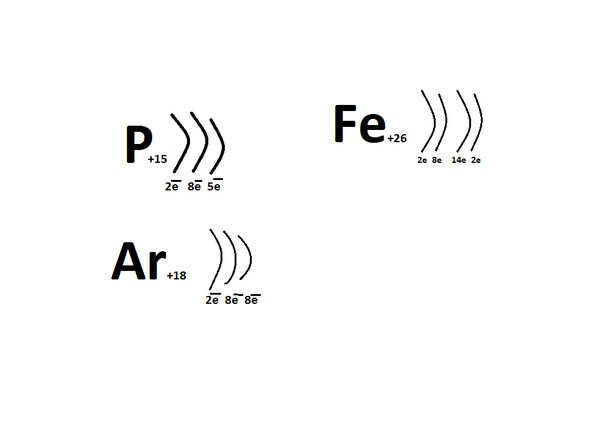
41.Электронная формула строения атома

.s.p.d
42.Электронно-графическая формула атома
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях. В такой формуле все электроны помечаются стрелочками, а квадратиками – орбитали.
пример:
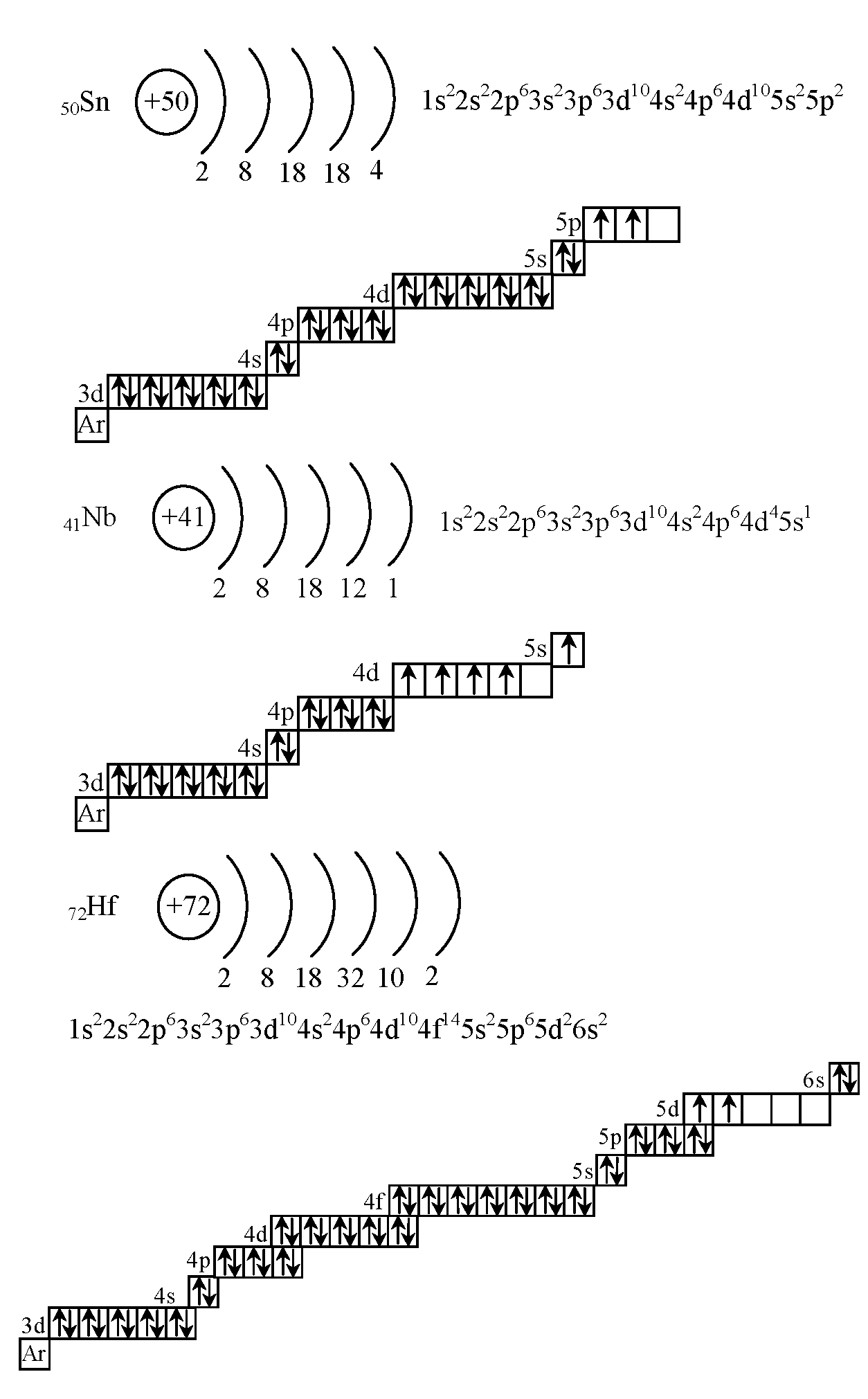
43. Классификация минеральных соединений.
Все неорганические соединения делятся на две большие группы:
Простые вещества — состоят из атомов одного элемента;
Сложные вещества — состоят из атомов двух или более элементов.
Простые вещества по химическим свойствам делятся на:
металлы(Li,Na, K, Mg, Ca и др.);
неметаллы(F2, Cl2,O2, S, P и др.);амфотерные простые вещества (Zn, Al, Fe, Mn и др.);
благородные газы(He,Ne, Ar, Kr, Xe, Rn).
Сложные вещества по химическим свойствам делятся на:
оксиды:
осно́вные оксиды(CaO,Na2Oи др.);
кислотные оксиды(CO2, SO3 и др.);
амфотерные оксиды(ZnO, Al2O3 и др.);
двойные оксиды(Fe3O4 и др.);
несолеобразующие оксиды(CO,NOи др.);
Гидроксиды;
основания (NaOH, Ca(OH)2 и др.);
кислоты(H2SO4,HNO3 и др.);
амфотерные гидроксиды(Zn(OH)2, Al(OH)3 и др.);
соли:
средние соли (Na2SO4, Ca3(PO4)2 и др.);
кислые соли (NaHSO3, CaHPO4 и др.);
осно́вные соли (Cu2CO3(OH)2 и др.);
двойные и/или комплексные соли (CaMg(CO3)2, K3[Fe(CN)6], KFeIII[FeII(CN)6] и др.);
бинарные соединения:
бескислородные кислоты(HCl,H2S и др.);
бескислородные соли (NaCl, CaF2 и др.);
прочие бинарные соединения (AlH3, CaC2, CS2 и др.)
44 Классификация оксидов
.По химическим свойствам оксиды подразделяют на следующие типы:
основные — им соответствуют основания;
амфотерные — им соответствуют амфотерные гидроксиды, которые соче-тают свойства оснований и кислот;
кислотные — им соответствуют кислоты;
несолеобразующие или безразличные— они не имеют своих гидроксидов и не вступают в реакции обмена (запомните их формулы: N2О, NO, CO, SiO и др.);
вода — занимает особое положение, по своим свойствам она является од-новременно и амфотерным, и несолёобразующим оксидом.
45. Классификация кислот
Кроме подразделения на кислоты Льюиса и кислоты Брёнстеда, последние принято классифицировать по различным формальным признакам:
По содержанию атомов кислорода:
бескислородные (HCl, H2S);
кислородсодержащие (HNO3, H2SO4).
По количеству кислых атомов водорода:
одноосновные (HNO3);
двухосновные (H2SeO4);
трёхосновные (H3PO4, H3BO3);
многоосновные.
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH,CH3COOH);
По летучести
Летучие (HNO3,H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
