
- •Список сокращений
- •Введение
- •Наночастицы
- •Состояние проблемы
- •Определение наночастиц
- •Классификация наночастиц
- •Свойства наночастиц
- •Пути поступления и биокинетика наночастиц
- •Системные эффекты наночастиц
- •Иисследование цитотоксичности наночастиц
- •Обьекты, методы исследований, приборы, оборудование
- •Наночастицы, используемые в экспериментах in vitro
- •Культуры клеток, используемые для изучения токсичности in vitro
- •Методы изучения цитотоксичности наноматериалов в культурах клеток млекопитающих
- •Перечень испытательного оборудования
- •Результаты исследований
- •Влияние наночастиц серебра на жизнеспособность клеток линий а549, shr и сублинии fl по результатам мтт-теста
- •Влияние наночастиц на жизнеспособность лимфоцитов человека по результатам мтт-теста
- •Изучение цитотоксичности наноматериалов для клеток линии а549 с помощью окраски метиленовым синим
- •Изучение жизнеспособности клеток в культуре по активности лактатдегидрогеназы в среде культивирования
- •Заключение
- •Список литературы
Методы изучения цитотоксичности наноматериалов в культурах клеток млекопитающих
Метилтетразолиевый тест
МТТ-тест предназначен для выявления метаболических нарушений, а именно нарушений функции митохондрий, отражающих влияние на жизнеспособность клеток. Клетки выращивали в СО2-инкубаторе (Herra Cell) при 37°С, 5% СО2, относительной влажности воздуха 80 % на 96-луночных планшетах (посевная концентрация – 50-70 тыс. кл./мл). В лунки с прикрепившимися клетками (вторые сутки культивирования) вносили исследуемые концентрации наносеребра, растворенного в сыворотке (Fetal Bovine Serum, Sigma, USA). После 24-часовой экспозиции исследуемых образцов фотометрически измерялась суммарная активность митохондриальных дегидрогеназ клеток в каждой лунке в метилтетразолиевом тесте (МТТ). Этот тест основан на способности живых метаболически активных клеток переводить соль тетразолина (MTS) в формазан, растворимый в среде культивирования. Таким образом, поглощение формазана прямо пропорционально количеству жизнеспособных клеток в культуре.
Для проведения МТТ использовали набор CellTiter 96® AQueous One Solution Cell Proliferation Assay (MTS), Promega. Для измерения поглощения формазана клетки инкубировали с МТS в течение 20 минут в термостате, измерение поглощения формазана при λ = 492 нм проводили на приборе для иммуноферментного анализа фирмы Awareness, Microplate Rider Stat Fax 3200.
Результат оценки статистически обработан средствами Excel. Токсичность наночастиц оценивалась по показателю IC50 (средняя ингибиторная концентрация – концентрация вещества, которая подавляет на 50% данную клеточную функцию).
Метод оценки жизнеспособности клеток в культуре с помощью окраски трипановым синим (метиленовым синим).
Оценка целостности клеточной мембраны является одним из наиболее распространенных способов измерить жизнеспособность клетки и цитотоксические эффекты. Соединения, обладающие цитотоксичностью, часто вызывают нарушение целостности клеточной мембраны, что можно установить с помощью витального окрашивания трипановым синим (метиленовым синим), который свободно проникает через поврежденную мембрану и окрашивает внутриклеточные компоненты, но в здоровых клетках отсутствует.
Для оценки жизнеспособности более надежным способом является окрашивание клеточных суспензий, поскольку при окрашивании прикрепленных клеток они могут открепляться от субстрата и теряться. Главным недостатком этого метода является невозможность выявления клеток с нарушенной способностью к размножению [14].
Для проведения эксперимента с различными концентрациями НЧ серебра (100, 300 мкг/мл) клетки линии А549 рассевали в 24-луночные планшеты. После окончания экспозиции (8 и 24 ч) клетки отмывали от наночастиц физиологическим раствором, окрашивали 0,4% раствором красителя. Количество мертвых окрашенных клеток подсчитывали в пяти произвольных полях зрения.
Метод оценки жизнеспособности клеток в культуре с помощью определения активности ЛДГ
Измерение активности лактатдегидрогеназы используется как один из основных тестов на цитотоксичность. Метод базируется на увеличении активности присутствующего в цитоплазме живых клеток фермента в среде культивирования, куда он выделяется через поврежденные мембраны мертвых или умирающих клеток. Небольшие количества культуральной среды берутся через определенные промежутки времени после воздействия на клетки для измерения высвобожденной лактатдегидрогеназы и определения зависимости токсического эффекта от временного фактора. В данном тесте можно оценить общую цитотоксичность в режиме реального времени.
Лактатдегидрогеназа – оксидоредуктаза, которая катализирует превращение пирувата и лактата. Клетки выделяют ЛДГ в кровяное русло после повреждения или гемолиза эритроцитов. Поскольку ЛДГ является стабильным ферментом, его широко используют для оценки наличия повреждения или токсичности для тканей и клеток. ЛДГ также повышается при определенных патологических условиях, таких как рак. В используемом наборе ЛДГ восстанавливает НАД+ в НАДН+, который специфически детектируется колориметрическим методом (450 нм).
Исходные растворы наночастиц готовили путем диспергирования в дистиллированной воде с добавлением альбумина при помощи четырехкратной ультразвуковой обработки общей продолжительностью 1 ч. Концентрация наносеребра – 100, 300, 600, 800, 1000 мкг/мл.
Для проведения теста использовали набор MAK066 Lactate Dehydrogenase Activity Assay Kit, Promega. Содержание ЛДГ определяли в бесклеточной среде путем добавления субстрата (НАД+, соль тетразолина, натрия лактат и др.). В ходе определения происходят следующие реакции: первая реакция – ЛДГ восстанавливает НАД+ в НАДН путем окисления лактата до пирувата). Во второй реакции катализатор (диафораза) передает H/H+ от НАДН к соли тетразолина, образуя формазан.
Для анализа использовали пробы сыворотки. Добавляли 2-50 мкл пробы в лунки 96-луночного планшета в двух повторностях. Пробы доводили до окончательного объема 50 мкл буфером для анализа ЛДГ.
В каждую лунку вносили по 50 мкл основной реакционной смеси. Хорошо перемешивали пипетированием. Через 2-3 минуты определяли Tисходное. Измеряли оптическую плотность (A450) при длине волны λ=450 нм в начальный момент времени. Планшеты инкубировали при 37 °C, проводя измерения (A450) каждые 5 минут. Время предпоследнего измерения – Tконечное. Для измерения поглощения формазана пробы инкубировали в течение 5 минут в термостате, измерение поглощения формазана проведено на приборе для иммуноферментного анализа фирмы Awareness, Microplate Rider Stat Fax 3200.
Определение концентрации продукта реакции превращения 7-этоксирезоруфина в 7-гидроксирезоруфин осуществляли на основании калибровки, построенной по экспериментальным данным (рисунок 3).
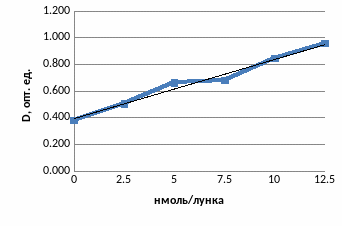
Рисунок 3 – Калибровочная прямая для определения активности ЛДГ
Согласно калибровке относительная единица оптической плотности соответствовала содержанию ЛДГ 0,430 нмоль/мин/мл (мЕ/мл).
