
- •Список сокращений
- •Введение
- •Наночастицы
- •Состояние проблемы
- •Определение наночастиц
- •Классификация наночастиц
- •Свойства наночастиц
- •Пути поступления и биокинетика наночастиц
- •Системные эффекты наночастиц
- •Иисследование цитотоксичности наночастиц
- •Обьекты, методы исследований, приборы, оборудование
- •Наночастицы, используемые в экспериментах in vitro
- •Культуры клеток, используемые для изучения токсичности in vitro
- •Методы изучения цитотоксичности наноматериалов в культурах клеток млекопитающих
- •Перечень испытательного оборудования
- •Результаты исследований
- •Влияние наночастиц серебра на жизнеспособность клеток линий а549, shr и сублинии fl по результатам мтт-теста
- •Влияние наночастиц на жизнеспособность лимфоцитов человека по результатам мтт-теста
- •Изучение цитотоксичности наноматериалов для клеток линии а549 с помощью окраски метиленовым синим
- •Изучение жизнеспособности клеток в культуре по активности лактатдегидрогеназы в среде культивирования
- •Заключение
- •Список литературы
Обьекты, методы исследований, приборы, оборудование
Наночастицы, используемые в экспериментах in vitro
2.1.1 Характеристика наночастиц серебра
Для проведения исследований использованы наночастицы серебра производства фирмы Aldrich, содержание наночастиц серебра 99,5% (следовые количества металлов), размер частиц <100 нм. Частицы имеют органическое покрытие для дисперсии в полярном растворителе.
Культуры клеток, используемые для изучения токсичности in vitro
Культура клеток карциномы легкого человека (А549).
Клетки культивируют в среде ДМЕМ с добавлением 10%-ой инактивированной телячьей эмбриональной сыворотки (FBS), 45 ЕД/мл пенициллина и 45 мг/мл стрептомицина в 5%-ой CO2 среде при 37 °C в CO2-инкубаторе (рисунок 2).
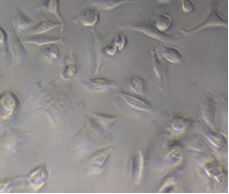
Рисунок 4 – Культура клеток А549
Культура клеток амниона человека, сублиния FL.
Морфология: эпителиоподобная. Способ культивирования: монослойный. Условия культивирования: среда - 199 или ЕМЕМ, сыворотка - КРС 10% (199); эмбриональная бычья10% (ЕМЕМ). Процедура пересева - cнятие клеток, используя версен 0,02% c химопсином 0,1 мг/мл, кратность рассева 1:4 - 1:10, оптимальная плотность 0,5-1,0х105 клеток/мл. Кариология: 2n=46, пределы изменчивости по числу хромосом 47-66, модальное число хромосом 60, количество маркеров 9, из которых 3 - специфичны для клеток НеLa (N 1,2,3, G диски). Изоэнзимы Г6ФДГ, А.16. Чувствительность к интерферону человека. Область применения: вирусология, канцерогенез, клеточная биология.
Культура лимфоцитов человека.
Культура лимфоцитов человека является одной из обязательных тест-систем при оценке влияния мутагенных факторов окружающей среды. Одним из достоинств этой тест-системы является то, что по наблюдаемым типам аберраций можно достаточно определенно идентифицировать тип мутагенного воздействия.
Культивирование лимфоцитов. Кровь отбирают из локтевой вены, помещают в стерильную пробирку, содержащую раствор гепарина (200 ЕД/мл крови). В стерильных условиях образцы крови переливают по 0,8 мл в приготовленные для культивирования флаконы Карреля с культуральной средой. Состав культуральной среды: 6,16 мл среды МЕМ; 1,6 мл инактивированной телячьей сыворотки; 0,08 мл L-глютамина; 0,08 мл р-ра антибиотика; 0,15 мл фитогемагглютинина. Флаконы помещают в термостат при 37°С для инкубации клеток в течение 48 ч. Для блокирования митоза на стадии метафазы за 2 ч до окончания инкубации во флаконы добавляют раствор демеколцина в концентрации 0,2 мкг/мл среды.
Гипотонизация клеток. После окончания культивирования культуру клеток переливают в центрифужные пробирки и центрифугируют при 10007 об./мин в течение 15 мин для осаждения клеток. Надосадочную жидкость удаляют с помощью водоструйного насоса, добавляют предварительно подогретый до 37°С гипотонический раствор (0,75 М KCl) и ресуспендируют в нем осадок. Далее пробирки с культурой клеток выдерживают на водяной бане (37°С) 10-12 мин. По окончании гипотонизации вновь центрифугируют при тех же условиях с последующим удалением надосадочной жидкости.
Фиксация клеток. Для фиксации клеток осадок ресуспендируют в 1-1,5 мл свежеприготовленного фиксатора (смесь метилового спирта и ледяной уксусной кислоты в пропорции 3:1) на шейкере и доводят его объем до 10 мл. Смену фиксатора с последующим центрифугированием производят трижды.
Культура кардиомиоцитов крыс линии SHR
Исходный материал для первичной культуры кардиомиоцитов крыс получают путем дезагрегации 0,25%-ным раствором трипсина при 37ºС в течение 30 мин сердечной ткани 12–14-суточных эмбрионов крысы. После удаления трипсина осадок суспендируют в ростовой среде (90% среды Игла, 10% эмбриональной сыворотки телят с добавлением антибиотиков). Суспензию пропускают через капроновый фильтр (ячейка 0,3 х 0,3 мм). После подсчета в камере Горяева клетки высевают в 96-луночные планшеты и культивируют в ростовой среде DMEM.
