
- •3. Ферментативный катализ_______________
- •3. Ферментативный катализ.
- •3.1 .Строение ферментов.
- •3.2. Механизм действия ферментов.
- •3.3. Специфичность ферментов.
- •3.4. Изоферменты.
- •3.5. Кинетика ферментативного катализа.
- •3.5.1. Зависимость скорости ферментативной реакции
- •3.5.2. Зависимость скорости ферментативной реакции
- •3.5.3. Зависимость скорости ферментативной реакции
- •3.5.4. Зависимость скорости ферментативной реакции от рН.
- •3.6. Ингибиторы ферментов.
- •3.7. Активаторы ферментов.
- •3.8. Регуляция скорости ферментативных реакций.
- •3.9. Классификация и индексация ферментов.
- •IV класс - лиазы – ферменты, катализирующие расщепление химических связей без присоединения воды:
- •V класс - изомеразы - ферменты, катализирующие изомерные превращения, т.Е. Перенос отдельных химических групп в пределах одной молекулы:
- •3.10. Номенклатура ферментов.
3.5.4. Зависимость скорости ферментативной реакции от рН.
Скорость ферментативных реакций значительно зависит от кислотности среды, в которой они протекают. Для каждого фермента имеется определенное значение рН, при котором наблюдается наибольшая скорость реакции – рН-оптимум. При отклонении в любую сторону от этого значения рН резко уменьшается ферментативная активность. Важно подчеркнуть, что величина рН-оптимума у разных ферментов колеблется в большом диапазоне значений рН, в то время как температурный оптимум для большинства ферментов составляет 37-40С. В качестве примера (см. рис.5) можно привести значения рН-оптимума следующих ферментов:
пепсин желудочного сока - 1,0-2,0
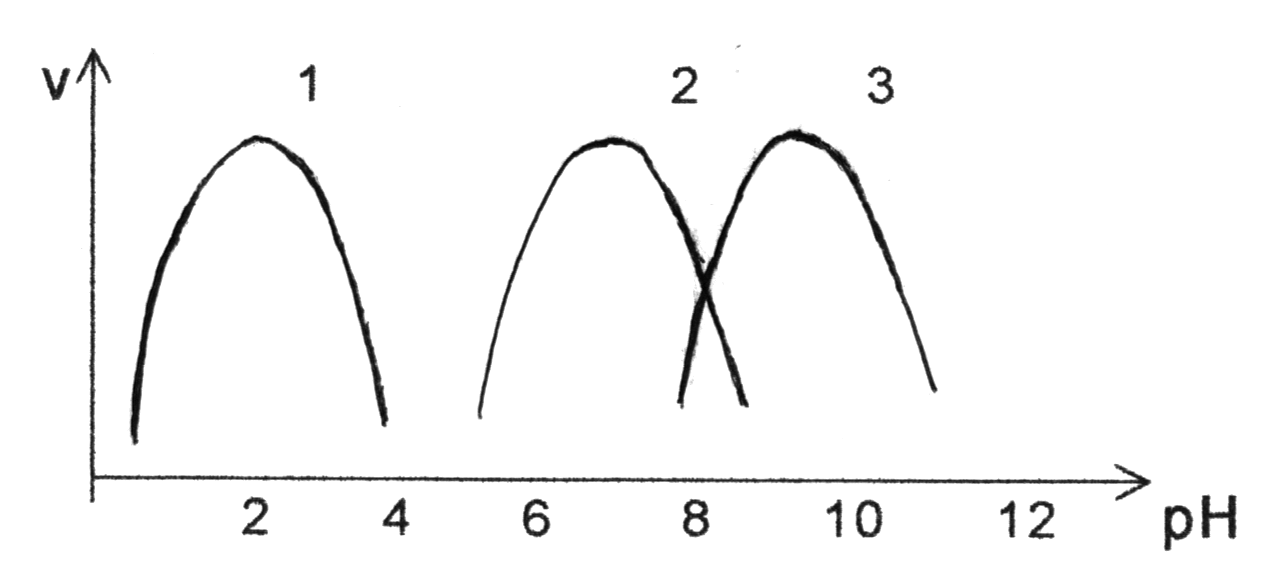 амилаза
слюны - 6,8-7,0
амилаза
слюны - 6,8-7,0
щелочная фосфатаза плазмы крови - 9,0-10,0
Рис. 5. Зависимость скорости ферментативной реакции от рН
(1 – пепсин, 2 – амилаза, 3 – щелочная фосфатаза )
Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента и, в том числе, изменяется конформация активного центра и способность его осуществлять катализ. При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значительном отклонении от рН-оптимума (в сильно кислой и сильно щелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности.
При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов.
3.6. Ингибиторы ферментов.
Скорость ферментативной реакции существенно зависит от присутствия ингибиторов и активаторов.
Ингибиторы (I) - это химические соединения (обычно низкомолекулярные), которые, находясь в низких концентрациях, избирательно тормозят определенные ферментативные реакции. При этом ингибитор всегда присоединяется к ферменту с образованием фермент-ингибиторного комплекса. Фермент, связанный с ингибитором, теряет свою каталитическую активность.
Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает во времени вплоть до полного прекращения ферментативной реакции:
 E
+ I EI
E
+ I EI
Такие ингибиторы называются необратимыми. Примером необратимых ингибиторов являются фосфорорганические соединения (табун, зарин, дихлофос, карбофос и др.), избирательно и необратимо угнетающие важнейший фермент организма холинэстеразу, участвующую в передаче нервных импульсов.
Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не зависит от времени:

 E
+ I
EI
E
+ I
EI
Ингибиторы такого типа называются обратимыми.
В свою очередь, обратимые ингибиторы делятся на две разновидности: конкурентные и неконкурентные.
Конкурентные ингибиторы присоединяются к активному центру фермента, т.е. к тому же участку поверхности фермента, что и субстрат. Поэтому между ингибитором и субстратом идет конкуренция за присоединение к активному центру. Занимая активный центр, ингибитор тем самым препятствует образованию фермент-субстратного комплекса - первой стадии ферментативного катализа. Конкурентные ингибиторы обычно по строению похожи на субстрат.
Неконкурентные ингибиторы присоединяются к ферменту вне активного центра. Этот участок поверхности фермента называется аллостерический центр (т.е. находящийся в другом месте по сравнению с активным центром).
Присоединение неконкурентного ингибитора к аллостерическому центру вызывает неблагоприятное изменение пространственной структуры (конформации) всей молекулы фермента, в т.ч. и активного центра. В результате каталитические свойства фермента снижаются.
Неконкурентные ингибиторы участвуют в регуляции скорости ферментативных реакций, протекающих в организме. В роли неконкурентных ингибиторов могут быть гормоны, конечные и промежуточные продукты ферментативных реакций, ионы металлов, лекарственные вещества.
