
- •1. Ядерно-физические свойства
- •1.1. Строение атома и элементарные частицы
- •1.2. Явление радиоактивности
- •1.3. Единицы измерения радиоактивности
- •1.4. Измерение радиоактивных излучений
- •1.5. Естественная радиоактивность горных пород
- •1.4.1. Формы нахождения радиоактивных элементов в горных породах
- •1.4.2. Радиоактивность магматических горных пород
- •1.4.3. Радиоактивность осадочных пород
- •1.4.5. Изменение радиоактивности пород
- •1.5. Свойства горных пород по отношению к нейтронному и гамма-излучению
- •1.3.1. Понятие сечения взаимодействия
- •1.3.2. Процессы взаимодействия гамма-квантов с горными породами
- •1.3.3. Гамма-параметры горных пород
- •1.3.4. Нейтроны и процессы их взаимодействия с горными породами
- •1.3.5. Нейтронные характеристики горных пород
- •2. Ядерная геохронология
- •2.1. Основные принципы ядерной геохронологии
- •2.2. Датирование древних геологических образований
- •2.3. Датирование молодых геологических образований
- •2.4. Возраст земли и ядерная космохронология
1. Ядерно-физические свойства
1.1. Строение атома и элементарные частицы
За единицу заряда принимается элементарный заряд
е=1,6010-19 Кл.
За единицу массы принимается 1/12 часть массы изотопа углерода с массовым числом 12. Эта единица называется атомной единицей массы (сокращенно а.е.м.);
1 а.е.м. = 1,6610-27 кг.
Масса наилегчайшего атома – атома водорода – равна 1,008 а.е.м.
За единицу энергии принимается электрон-вольт (эВ)
1 эВ=1,6010-19 Дж.
Моменты импульсов частиц выражаются в
единицах
![]() ,
магнитные моменты электронов – в
единицах
,
магнитные моменты электронов – в
единицах
![]() ,
магнитные моменты ядер – в единицах
,
магнитные моменты ядер – в единицах
![]() .
.
В этих выражениях:
![]() – постоянная Планка, е – элементарный
заряд, те – масса
электрона, тр – масса
протона. Единица
– постоянная Планка, е – элементарный
заряд, те – масса
электрона, тр – масса
протона. Единица
![]() называется магнетоном Бора,
называется магнетоном Бора,
![]() – ядерным магнетоном.
– ядерным магнетоном.
Магнетон Бора
![]() Ам2
.
Ам2
.
Ядерный магнетон
![]() Ам2.
Ам2.
В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны. Основная масса атома (99,9599,97 %) сосредоточена в ядре.
Ядро самого легкого атома – водорода
![]() – состоит из одного протона. Масса
протона – 1,67210-27
кг, нейтрона – 1,67510-27
кг, электрона – 9,1110-31
кг (1/1836 часть массы протона).
– состоит из одного протона. Масса
протона – 1,67210-27
кг, нейтрона – 1,67510-27
кг, электрона – 9,1110-31
кг (1/1836 часть массы протона).
Заряд электрона и протона равен элементарному электрическому заряду e. Положительный заряд протона равен по абсолютному значению элементарному заряду. Число элементарных зарядов ядра равно порядковому номеру элемента в Периодической системе Менделеева. Количество электронов в атоме (нейтральном) равно числу элементарных зарядов ядра.
Движение электронов в атоме можно приближенно описывать как движение вокруг ядра по определенным круговым и эллиптическим орбитам (рис. 1.1). Эти орбиты называют стационарными. Двигаясь по стационарным орбитам электрон, несмотря на наличие у него ускорения, не излучает. Радиусы стационарных круговых орбит определяются из условия
|
(1.) |
где те – масса электрона;
vп – его линейная скорость;
rп – радиус n-ой орбиты;
![]() – постоянная Планка;
– постоянная Планка;
n=1, 2, 3, ...
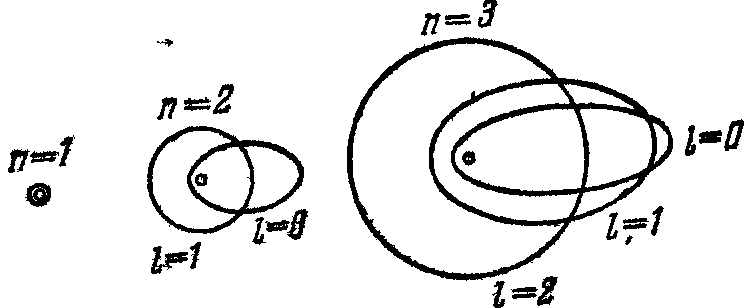
Рисунок 1.1. – Возможные орбиты электрона в атоме водорода
(для различных квантовых чисел). Большие полуоси эллипса относятся
как квадраты целых чисел 12; 22; 32; 42 и т. д.
Определенным стационарным орбитам электронов (точнее, стационарным состояниям атома) соответствуют определенные значения энергии (дискретные уровни энергии).
Атом
излучает электромагнитную энергию,
если электрон переходит с удаленной
от ядра стационарной орбиты на ближнюю;
при переходе электрона с ближней орбиты
на дальнюю атом поглощает энергию.
Величина излученного или поглощенного
при переходах кванта энергии
![]() определяются условием
определяются условием
|
(1.2) |
где ![]()
![]() – дискретные уровни энергии в атоме до
и после перехода электрона.
– дискретные уровни энергии в атоме до
и после перехода электрона.
По современным представлениям, электронных орбит не существует; имеется электронное распределение и рассчитывается лишь вероятность того, что электрон находится на определенном расстоянии от ядра. Однако и в современных теориях понятие о дискретных уровнях энергии атома остается в силе.
Состояние электрона в атоме (точнее, состояние атома в целом) определяется четырьмя квантовыми числами n, l, m, s:
главное квантовое число n может принимать значения 1, 2, 3, 4, ... и характеризует номер электронной оболочки, на которой находится электрон;
орбитальное квантовое число l указывает на форму орбитали и может иметь целочисленные значения от 0 до (n1). Орбитали с l=0, 1, 2, 3 также называются s-, p-, d- и f-орбиталями;
магнитное квантовое число m, возможные варианты пространственной ориентировки орбитали характеризует принимающее целочисленные значения от -l до l, включая нуль;
спиновое квантовое число имеет единственное значение, равное ½.
Каждому электрону в атоме соответствует некоторый энергетический уровень, определяемый комбинацией значений трех квантовых чисел (n, l, m) и так называемой орбиталью. Понятием орбиталь в квантовой механике заменяется классическое представление об орбите электрона.
Спиновое квантовое число определяет собственный момент импульса Ms электрона (спина) и его возможные проекции Мsz,
|
(1.3) |
Принято говорить, что спин электрона
(или другой частицы) равен одной второй
(½), при этом подразумевается, что проекции
собственного момента импульса равны
![]() .
.
Четыре квантовых числа определяют энергетические электрона.
Состояния электронов входящих в состав одного и того же атома, отличаются друг от друга хотя бы одним значением квантового числа. Эта закономерность называется принципом Паули, которому подчиняются все частицы, имеющие полуцелый спин (фермионы).
При переходе электрона с одного энергетического уровня другой изменяются квантовые числа, определяющие его состояние. Как показывают теория и опыт, переход электрона возможен на такие уровни, когда изменение m=0, 1, изменение l=±1.
В атоме совокупность электронов, которые имеют одинаковые квантовые числа п, образую слой или группу; совокупность электронов, имеющих одинаковые квантовые числа п и l образует оболочку (орбиталь). Слои значениям главного буквами К, L, M, N и т.д. (что соответствует значениям главного квантового числа п=1, 2, 3, 4, ...), оболочки обозначаются буквами s, p, d, f и т.д. Наибольшее число электронов в слое равно 2п2. Заполнение оболочек у многоэлектронных атомов числа осуществляет в следующей последовательности 1s, 2s, 2p, 3s, 3р, 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Химические свойства атомов определяются электронами его внешней оболочки. При переходах электронов во внешних оболочках излучаются световые и ультрафиолетовые электромагнитные волны.
Если из внутренней оболочки атома удалить электрон, то на эту оболочку будут самопроизвольно переходить электроны из других оболочек с большими номерами п. При таких переходах излучается характеристическое рентгеновское излучение с линейчатым спектром. Линии этого спектра соединяются в серии. Каждая серия определяется тем слоем, в который переходят электроны на вакантные места. Эти серия принято обозначать такими же буквами, какими обозначаются и слои: К, L, М, N,... Длины волн этих спектров определяются только дискретными уровнями энергии атомов данного вещества. Наиболее коротковолновое излучение соответствует К-серии.
Основные характеристики стабильных ядер – массовое число А, электрический заряд Ze, масса М, энергия связи Е, радиус R, спин I, магнитный момент и другие величины.
Атомное ядро любого элемента состоит из протонов и нейтронов. Спин у нейтрона и протона, равен (1/2) .
Атомы, имеющие одинаковый заряд ядер (и одинаковое число протонов), но отличающиеся друг от друга числом нейтронов, называются изотопами. Количество протонов и нейтронов, входящих в состав ядра, называется массовым числом (А).
Число нейтронов в ядре N=A–Z, где Z – атомный номер ядра, равный порядковому номеру атома в периодической системе. Заряд ядра равен Ze. Обе частицы – протон и нейтрон – называются нуклонами (ядерными частицами). Ядра, у которых число нейтронов одному из следующих чисел: 2, 8, 20, 28, 60, 82 и 120, называются магическими ядрами, а сами числа – магическими числами. Такие ядра имеют наибольшую стабильность.
Плотность ядра очень большая (порядка 1011 кг/см3), размер ядра имеет порядок 10-13 см (1 ферми).
Радиус ядра приближенно рассчитывается по формуле
|
(1.4) |
где А – массовое число, R0=(1,2–1,3)10-13 см.
Спин ядра образуется из спинов нуклонов и их орбитальных моментов. Суммарный момент ядра, состоящий из четного числа протонов и четного числа нейтронов, равен нулю; момент ядра, которое состоит из нечетного числа нуклонов, определяет моментом непарного нуклона, т.е. i=s+l (s – спин непарного нуклона, l – орбитальный момент, выраженные в единицах .
Нуклид – ядро любого элемента, которое имеет определенное строение и состав.
Нуклоны внутри ядра связаны особыми силами, которые называются ядерными силами. Ядерные силы в значительной мере зависят от расстояния между нуклонами; на расстоянии 110-13 см ядерные силы между нуклонами приблизительно в 135 раз больше сил электрического отталкивания и в 1038 раз больше гравитационного взаимодействия. На расстояниях меньше 0,710-13 см ядерные силы действуют как силы отталкивания, на расстояниях больше – 0,710-13 см – как силы притяжения, на расстоянии 210-13 см их действие равно нулю. Ядерные силы не зависят от электрического заряда и обладают свойством насыщения.
Ядерные силы имеют три составляющие: центральная сила, зависящая от расстояния, спин-спиновая сила и спин-орбитальная сила, которая возникает в результате искривления траектории одного нуклона при прохождении вблизи другого.
Энергия покоя частицы определяется
соотношением
![]() (т – масса покоя частицы, с
– скорость света в вакууме). Ядро с
массой М имеет энергию покоя
(т – масса покоя частицы, с
– скорость света в вакууме). Ядро с
массой М имеет энергию покоя
![]() .
.
При образовании ядра ядерными силами
производится работа, вследствие чего
энергия покоя Е образовавшегося
ядра будет меньше суммы покоя
![]() ,
где
,
где
![]() – масса покоя протона,
– масса покоя протона,
![]() – масса покоя нейтрона. Величина
– масса покоя нейтрона. Величина
|
(1.5) |
называется энергией связи ядра, а разность между массами невзаимодействующих нуклонов и массой образовавшегося из них ядра называется дефектом масс М:
|
(1.6) |
