
- •22.03.02 (150400.62) «Металлургия»
- •Содержание
- •Введение
- •Практическое занятие № 1
- •1.1 Теоретическое введение
- •1.2 Примеры решения задач
- •1.3 Задачи для самостоятельного решения
- •2.1 Теоретическое введение
- •2.2 Примеры решения задач (по теме «Показатели скорости газовой коррозии»)
- •2.3 Задачи для самостоятельного решения
- •2.4 Теоретическое введение Условие сплошности оксидных пленок на металлах
- •2.5 Примеры решения задач (по теме «Условие сплошности оксидных пленок»)
- •2.6 Задачи для самостоятельного решения
- •3.1. Теоретическое введение
- •Параболический закон окисления металла
- •Логарифмический закон окисления металлов
- •3.2 Примеры решения задач
- •3.3 Задачи для самостоятельного решения
- •Практическое занятие № 4 Защита металлов от газовой коррозии: выбор и расчет защитных атмосфер
- •4.1 Теоретическое введение
- •4.2 Примеры решения задач
- •4.3 Задачи для самостоятельного решения
- •5.1 Теоретическое введение
- •5.2 Примеры решения задач
- •5.3 Задачи для самостоятельного решения
- •6.1 Теоретическое введение
- •1 Катодная поляризация
- •1.1 Водородная деполяризация
- •1.2 Кислородная деполяризация
- •2 Анодная поляризация
- •3 Аналитический расчет процесса коррозии
- •3.1 Особенности коррозии с кислородной поляризацией
- •6.2 Примеры решения задач
- •6.3 Задачи для самостоятельного решения
- •7.1 Теоретическое введение
- •Легирование
- •Обработка коррозионной среды
- •Защитные покрытия
- •7.2 Примеры решения задач
- •7.3 Задачи для самостоятельного решения
3.1. Теоретическое введение
Скорость химической коррозии металлов определяется или скоростью самого кристаллохимического процесса образования пленки, или скоростью встречной двусторонней диффузии через пленку действующего реагента и металла.
Линейный закон окисления металла
Если при окислении металлов протекают процессы, не приводящие к образованию сплошной оксидной пленки, что возможно при наличии возгоняющихся в данных условиях оксидов, рыхлых пористых или растрескивающихся оксидов, скорость коррозии может контролироваться, либо скоростью химической реакции кислорода и металла, либо скоростью процессов, вызывающих нарушение целостности оксидной пленки. В предельном случае, когда продукты взаимодействия не защищают металл от окислительной среды, скорость окисления будет определяться также скоростью химической реакции. Таким образом, максимально возможная скорость химической коррозии металла - это скорость химической реакции взаимодействия металла и кислорода.
Так как в рассмотренных случаях пленка практически не препятствует окислению металла ни на одном этапе, то скорость окисления должна оставаться постоянной в течение всего процесса окисления.
dh / dτ = K1 (3.1)
где K1 - константа скорости роста оксидной пленки, зависящая от концентрации кислорода в газовой фазе и давления газа (с увеличением этих параметров она также увеличивается); h - толщина пленки; τ - время.
Интегрирование уравнения (3.1) дает возможность найти закон роста пленки во времени:
h = K1τ+С1 (3.2)
этот закон называется линейным. С1 - постоянная интегрирования, равная толщине пленки в начальный момент: С1 = h0 при τ = 0. Если h0 =0 (при τ = 0), то С = 0 и уравнение (3.2) принимает вид:
h = K1 ∙ τ (3.3)
Для нахождения константы K1 в случае линейного закона строится график (см. рисунок 1) в координатах h = f(τ), представляющий собой прямую линию, тангенс угла наклона которой равен K1(tgα = K1).

Риcунок – 1 Законы роcта пленок на металлах: линейный,
параболический и логарифмический законы в координатах h - τ
Параболический закон окисления металла
Параболическое окисление наблюдается в тех случаях, когда на поверхности металла образуется сплошная, плотно прилегающая к его поверхности оксидная пленка. Закономерности роста такой пленки определяются закономерностью перемещения в ней частиц окислителя и металла. Такими частицами в общем случае могут быть катионы, анионы и электроны. Механизм перемещения частиц в пленке представляет собой диффузию. Независимо от места расположения зоны роста пленки (со стороны газовой среды, металла или внутри пленки), кинетическая закономерность окисления одинакова - она выражается уравнением квадратичной параболы. Уравнение роста оксидной пленки в этом случае имеет вид:
h2 = K2 τ . (3.4)
Параболический закон окисления имеет место при взаимодействии с кислородом многих металлов. Однако наиболее часто на практике встречается закономерность окисления, описываемая степенным законом роста (см. рисунок 1)
![]() ,
(3.5)
,
(3.5)
где К3 - константа скорости окисления; n - показатель степени, причем 1< n ≤2 или n >2; иногда окисление описывается кубическим уравнением.
Если кривая имеет вид зависимости (3.5), то для подтверждения справедливости установленной зависимости, нахождения показателя n и константы K3 кривую спрямляют, строят график (см. рисунок 2) в координатах lg h = f(lg τ), который для параболической зависимости должен дать прямую
lgh = 1/n lg K3+1/n lg τ ,
где 1/n = tg α, lgK3/n - отрезок, отсекаемый на оси ординат (при lg τ = 0).

Рисунок 2 – График для определения параметров " n " и "К3" в случае параболического закона роста пленок
Значение показателя n и константы К3 находят из графика: 1) n = ctg α , 2) 1/n lg K3 = lgh при lg τ = 0 или
lg K3 = n lgh, откуда при известном значении n рассчитывается значение постоянной K3.
Возможны случаи, когда первоначально процесс окисления металлического материала может протекать с образованием защитной оксидной пленки с показателем n ≥ 2 в кинетическом уравнении (3.5), а с увеличением длительности изотермической выдержки происходит разрушение (растрескивание, осыпание) оксидной пленки, и n становится ≤ 1.
Изменение в структуре пленки по мере ее роста может привести к изменению величины n и К3 в уравнении (3.5). Смена законов в процессе окисления металлов характерна для так называемого паралинейного закона (в начальный период - параболический, затем - линейный закон). Переход к линейному закону соответствует установлению равенства скоростей образования окисла (во внутренней части) и разрушения его (снаружи).
Для описания зависимости толщины пленки от времени (1<n<2), в общем виде может быть использовано уравнение, предложенное Эвансом
K1h2+K2h = K1K2 τ (3.6)
Для нахождения неизвестных K1 и K2 уравнение преобразуют к виду: τ/h =1/K1+h/K2 и строят график в координатах τ/h = f(h), который должен дать прямую линию (см. рисунок 3). Тангенс угла наклона этой линии tgα = 1/K2 , а 1/K1 - отрезок, отсекаемый на оси ординат (при h = 0).
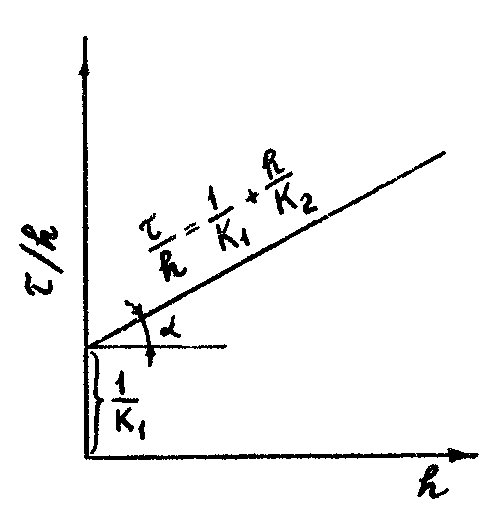
Рисунок 3 – Параболический закон в координатах (τ/h)–h
