
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
3.1.5.2 Змочування поверхні твердого тіла рідиною
Змочуванням називають ізотермічний самочинний процес, який виникає при контакті поверхні твердого тіла з рідиною в результаті молекулярної взаємодії між ними.
Явище змочування полягає в тому, що крапля рідини, поміщена на поверхню твердого тіла, розтікається. До речі, механізм розтікання рідин на твердій поверхні відрізняється від механізму розтікання на поверхні рідин, для яких характерною є молекулярна рухливість. На твердих поверхнях рідини розтікаються завдяки дифузії, капілярності, леткості рідини, а також з інших причин. Умови ж розтікання залишаються такими ж, як і у випадку розтікання на рідинах.
На
рис. 3.6 наведено поперечний переріз
краплі рідини (2), поміщеної на поверхню
твердого тіла (1) в атмосфері газу (3). На
межі цих фаз будуть спостерігатись
поверхневі натяги
![]() ,
,
![]() і
і
![]() .
При прикладенні цих трьох сил до однієї
точки на межі трьох фаз (точка а) крапля
буде рухатися, поки не наступить їх
рівновага. Умову рівноваги виражає
рівняння Юнга
.
При прикладенні цих трьох сил до однієї
точки на межі трьох фаз (точка а) крапля
буде рухатися, поки не наступить їх
рівновага. Умову рівноваги виражає
рівняння Юнга
![]() або
або
![]() ,
,
де
кут
![]() називається крайовим
кутом змочування.
Кут
є мірою селективного змочування,
характеризуючи взаємовідношення
поверхні твердого тіла і рідини. При
змочуванні
називається крайовим
кутом змочування.
Кут
є мірою селективного змочування,
характеризуючи взаємовідношення
поверхні твердого тіла і рідини. При
змочуванні
![]() і
і
![]() ,
тому
,
тому
![]() .
У випадку незмочування
.
У випадку незмочування
![]() і
і
![]() ,
а отже
,
а отже
![]() .
.
Т аким
чином, змочування поверхні твердого
тіла рідиною може відбуватися тільки
в тому випадку, коли поверхневий натяг
між поверхнею твердого тіла і рідиною
(
)
буде меншим, ніж поверхневий натяг між
твердим тілом і газом (
).
В противному випадку рідина не буде
змочувати поверхню твердого тіла.
аким
чином, змочування поверхні твердого
тіла рідиною може відбуватися тільки
в тому випадку, коли поверхневий натяг
між поверхнею твердого тіла і рідиною
(
)
буде меншим, ніж поверхневий натяг між
твердим тілом і газом (
).
В противному випадку рідина не буде
змочувати поверхню твердого тіла.
Поверхні твердого тіла, які змочуються рідиною, називаються ліофільними. Поверхні твердого тіла, які не змочуються рідиною, – ліофобними. У випадку, якщо рідиною є вода чи водні розчини, поверхні твердого тіла називаються відповідно гідрофільними чи гідрофобними. У випадку неполярних органічних рідин будемо мати олеофільні (ліпофільні) чи олеофобні (ліпофобні) тверді тіла.
Поверхню твердого тіла можна модифікувати, тобто з ліофільної зробити ліофобну, і навпаки, за допомогою поверхнево-активних речовин. Детально цей процес розглядається в розділі “Поверхнево-активні речовини”.
Оскільки
поверхнева енергія на межі тверде тіло
– газ більша, ніж на межі тверде тіло –
рідина, то при змочуванні виділяється
тепло (![]() ),
що дорівнює різниці поверхневих енергій
),
що дорівнює різниці поверхневих енергій
![]() ,
,
де ![]() – поверхнева енергія на межі тверде
тіло – газ,
– поверхнева енергія на межі тверде
тіло – газ,
![]() –
поверхнева
енергія на межі тверде тіло – рідина.
–
поверхнева
енергія на межі тверде тіло – рідина.
Ця
теплота називається теплотою
змочування.
Якщо поверхню твердого тіла, уже змочену
![]() молями якоїсь рідини, ввести в повний
контакт з рідиною, то відбувається
подальша зміна вільної енергії поверхні
молями якоїсь рідини, ввести в повний
контакт з рідиною, то відбувається
подальша зміна вільної енергії поверхні
![]()
![]() ,
,
де ![]() – тиск насиченої пари рідини,
– тиск насиченої пари рідини,
![]() – пружність
пари над твердим тілом, що містить
моль рідини.
– пружність
пари над твердим тілом, що містить
моль рідини.
Користуючись рівнянням Гіббса-Гельмгольца, можна розрахувати диференціальну мольну теплоту змочування
![]() .
.
Зі
збільшенням
теплота змочування
зменшується. Найбільше значення вона
має при
![]() .
.
При
![]() теплота змочування дорівнює нулю. Тому
вона відповідає максимальній кількості
рідини, яка здатна взаємодіяти з поверхнею
твердого тіла, виділяючи при цьому
тепло. Отже, таким способом можна знайти
граничну кількість рідини, яка насичує
поверхню.
теплота змочування дорівнює нулю. Тому
вона відповідає максимальній кількості
рідини, яка здатна взаємодіяти з поверхнею
твердого тіла, виділяючи при цьому
тепло. Отже, таким способом можна знайти
граничну кількість рідини, яка насичує
поверхню.
Перший
член правої частини рівняння є теплотою
конденсації пари на поверхні в рідину,
“зв’язану” полем поверхневих сил (![]() ).
Другий член правої частини рівняння
являє собою теплоту конденсації пари
у “вільну” рідину (
).
Другий член правої частини рівняння
являє собою теплоту конденсації пари
у “вільну” рідину (![]() ).
Отже,
).
Отже,
![]() .
.
Д
Рисунок
3.7 − Залежність інтегральної (i)
і диферен-ціальної (д)
теплоти змочу-вання від кількості
нанесеної рідини (x)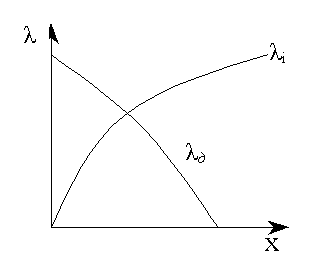
![]() є завжди позитивною, тобто при змочуванні
теплота виділяється.
є завжди позитивною, тобто при змочуванні
теплота виділяється.
Якщо
занурити одиницю маси твердої речовини
в рідину, то її поверхня поглине
![]() моль рідини, виділяючи
моль рідини, виділяючи
![]() тепла. Величина
є інтегральною
мольною теплотою змочування.
З величиною
вона пов’язана рівнянням
тепла. Величина
є інтегральною
мольною теплотою змочування.
З величиною
вона пов’язана рівнянням
![]() .
.
Інтегральну теплоту змочування при нанесенні рідини, взятої з надлишком, яка уже на взаємодіє з поверхнею, називають повною або просто теплотою змочування. Для її визначення за попереднім рівнянням інтеграл береться від нуля до нескінченності. Чим більше змочуючої рідини, тим менша диференціальна і більша інтегральна теплота змочування (рис. 3.7). В граничних умовах, коли надлишкова кількість рідини вже не взаємодіє з поверхнею, диференціальна теплота змочування рівна нулю, а інтегральна – повній теплоті змочування. Інтегральна теплота змочування вимірюється кількістю енергії (роботи), віднесеної до одиниці поверхні твердого тіла (Дж/м2). Диференціальна теплота змочування вимірюється в Дж/моль рідини.
Теплота змочування є важливою характеристикою поверхні розділу тверде тіло – рідина. Поряд з краєвим кутом змочування вона дає змогу характеризувати ліофільність та ліофобність поверхні твердого тіла. З двох рідин, що змочують поверхню твердого тіла, більшою теплотою змочування володіє та рідина, полярність якої менше відрізняється від полярності твердого тіла.
Змочуваність деяких твердих тіл водою характеризується такими краєвими кутами: кварц – 0, малахіт – 17, графіт – 55, тальк – 69, парафін – 106, тефлон – 108.
С елективне
змочування лежить в основі флотації
– збагачення руд, які є гідрофобними і
органофільними; пуста порода, навпаки,
є гідрофільною.
елективне
змочування лежить в основі флотації
– збагачення руд, які є гідрофобними і
органофільними; пуста порода, навпаки,
є гідрофільною.
