
ҚАЗАҚСТАН РЕСПУБЛИКАСЫ
БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
ҚАЗАҚ МЕМЛЕКЕТТІК ҚЫЗДАР ПЕДАГОГИКАЛЫҚ
УНИВЕРСИТЕТІ
Жаратылыстану факультеті
Химия кафедрасы

«Химияны оқыту әдістемесі» бойынша
Курстық жұмыс
Тақырыбы: Орта мектеп химия курсындағы металдардың жалпы қасиеттерін оқып үйретудің әдістемесі»
Орындаған: Ш.О.Сағынай
5В060600 – химия, 3 курс,
314 – топ студенті
Тексерген: Ж.Қ.Қуанышева
Алматы – 2013
Жоспар
I. Кіріспе
1.1. Орта мектеп курсында жалпы металдар туралы материалдардың оқытылуы.
II. Негізгі бөлім
2.1. 8-сынып бойынша сілтілік металдар туралы материалдарың қарастырылуы.
2.2. 9-сыныпта металдар және оның қосылыстарының оқылытуы.
2.3. 10- сынып бойынша металдардың қосылыстарының өтілуі.
2.4. 11- сынып бойынша металдық байланыстың қарастырылуы.
2.5. «Металдар» тақырыбына арналған кеш.
III. Қорытынды
Пайдаланылған әдебиеттердің тізімі
Кіріспе
Курстық жұмыстың мақсаты: Мектеп курсында металдардың қасиеттерін оқытудың әдістемелерін қарастыру.
Орта мектеп курсында жалпы металдар 8-сыныптан бастап оқытылады. Осы сыныпта жалпы химиялық элементтер 2-ге бөлінеді:
Металдар
Бейметалдар
Соның ішінде бірінші сілтілік металдар қарастырылады. Сілтілік метал натрий. Сілтілік металдар I топтың негізгі топшасында орналасқан. Сілтілік металдар – литий, натрий, калий, рубидий, цезий ең белсенді металдарға жатады.
Сілтілік металдарға тән ерекшеліктерді олардың кең таралған өкілі натрийді мысалға ала отырып қарастырады. Оның атом құрылысы, табиғатта кездесуі, физикалық қасиеті, химиялық қасиеті, алынуы, қолданылуы түгелдей қарастырылады. Ал, 9-сыныпта металдардың жалпы қасиеттері, периодтық жүйедегі орны,атом құрылысының ерекшелігі, табиғатта кездесуі, алынуы, физикалық қасиеттері, металдарға тән химиялық қасиеттер, металдар коррозиясы және одан сақтандыру, сілтілік металдардың сипаттамасы қарастырылады. Сонымен қазір белгілі ашылған 108 элементтің көпшілігі (80-нен астамы) металдарға жатады. Химиялық элементтердің Д.И. Менделеев жасаған периодтық жүйесіндегі металдар қандай орын алады? Бұл сұраққа жауап беруден бұрын едәуір аз болса да бейметалдардың мұнда қалай орналасқаны еске түсіріледі. Металдардың негізінен периодтық жүйенің сол жағына және төменгі бөлігіне, ал бейметалдардың оң жақ бөлікте жоғары орналасатынын көрсетіледі. Метал атомдарының сыртқы энергетикалық деңгейінде көбінесе бірден үшке дейін электрондар орналасады. Әдетте олардың атомдарының радиусы үлкен болып келеді. Бейметалдар атомына қарағанда металдар атомдары сыртқы электрондарын оңай береді, яғни күшті тотықсыздандырғыш болып табылады.Сондықтан металл атомы оң зарядты иондарға айналады. Атомнан бөлінген электрондар металдардың оң зарядталған иондарының арасында біршама бос араласып кетеді. Бұл бөлшектердің арасында байланыс пайда болады, кристалл торларының түйіндеріндегі электрондар оң зарядты иондардың жеке қабаттарын цементтеп тастағандай болады. Электрондар үздіксіз қозғалыста болатындықтан, оң зарядты иондармен соқтығысқан кезде оң зарядты иондар бейтарап атомға, ал соңынан қайтадан ионға айналады. Кристал тордың түйіндерінде болатын оң зарядты иондар және бейтарап атомдардың кейбір санының арасында қозғалатын біршама бос электрондар металдық кристалл торы деп аталады. Бұндай біршама бос электрондар мен металл иондарының арасында түзілетін кристалдық тор металдық байланыс деп аталады. Сонымен металдардың жалпы қасиеттеріне келетін болсақ, металдардың барлығына тән қасиет – металдық жылтыр. Бұл қасиетті металдар беті шағылыстыратын жарық сәулесі арқылы түсіндіруге болады. Металдар сондай – ақ радиотолқынын да шағылыстыра алады. Бұл құбылыс өте алысқа ұшатын ұшақтарды анықтайтын радиолокаторларға пайдаланылады. Негізінен металдардың периодтық жүйедегі орны туралы кіріспе оқылып, мына мәселелерге назар аударылады: ″метал″ термині химиялық элементтерді және олар түзетін жәй заттарды белгілейді; бір термин арқылы берілетін екі ұғымның әрқайсысының өзіндік мазмұны және көлемі нақтыланады; периодтық жүйеде орналасуы, салыстырмалы атомдық массасы, реттік нөмірі, атом радиусы, иондану энергиясы, т.б. элементке тән сипаттамалар. Металдарға жататын химиялық элементтер саны жағынан бейметалдардан гөрі көбірек, сексеннен асады. Негізгі және қосымша топшалардың металдарын оқыту. Химиялық элеметтерді оқып үйрену жоспары және жалпы қасиеттері оқушыларға таныс болғандықтан, негізгі және қосымша топшалардың металдары мәселелі әдіспен және оқушылардың өздігінен істейтін жұмыстарын ұйымдастыру арқылы оқытылады. Олар I-III негізгі топшаларда (бордан басқа) және барлық топшаларда периодтық жүйенің сол жағында орналасқан. Металл атомдарының негізгі ерекшелігі – сыртқы қабатындағы электрондар саны аз, атом радиуыстары едәуір үлкен. Әр период S- деңгейшесін электрондармен толтыратын сілтілік металдардан басталады. Үлкен периодтардың ортасында орналасқан металдар атомдары (Sc – Zn, V – Cd ) деңгейшесін, аса үлкен периодтарда орналасқан металдар d - деңгейшесін, және f- деңгейшелерін электрондармен толықтырады. Металл атомдары сыртқы және оның астындағы электрондық қабаттарынан валенттік электрондарын беріп жіберіп, тотықсыздандырғыш қасиет көрсетуге бейім келеді. Бұған металдардың және оқушыларға таныс бейметалдардың иондану энергияларын салыстыру арқылы көз жеткізеді. Металдардың жай заттарын белгілейтін терминнің мағынасы олардың атомдары түзетін химиялық байланыстың табиғатын және кристалл торлардың түрлерін қарастыру арқылы ашылады. Металдық химиялық байланыс ковалентті және иондық байланыстармен, молекулалық, атомдық, иондық кристалл торлары металдық кристалл торымен салыстырылып, ұқсастығы мен айырмашылығы анықталады. 10-сыныпта жалпы қасиеттері, негізгі және қосымша топша металдары қайта күрделі түрде қарастырылады, сонымен қатар сілітілік металдарға сипаттама беріледі, ал 11-сыныпта химиялық байланыстардың түрлері оның ішінде металдық байланыс қарастырылады [1,5].
2.1. 8-сынып бойынша сілтілік металдар туралы материалдарың қарастырылуы.
Сілтілік металдар I топтың негізгі топшасында орналасқан. Сілтілік металдар – литий, натрий, калий, рубидий, цезий ең белсенді металдарға жатады.Сілтілік металдарға тән ерекшеліктерді олардың кең таралған өкілі натрийді мысалға ала отырып қарастырады.
Атом құрылысы. Натрий III периодтың I негізгі топшасында орналасқан. Ол сілтілік металдардың қатарына жатады, себебі сумен әрекеттескенде сілті түзеді. Натрий III периодтағы мөлшері ең үлкен атом сыртқы энергетикалық деңгейінде бір ғана электроны бар.Сондықтан натрий басқа сілтілік металдар тәрізді, өзінің валенттік электронын оңай беретін өте белсенді металл.
+11Na ) 2ē ) 8 ē ) 1 ē.
Электрондық формуласы: +11Na 1s2 2s2 2p6 3s1
 Графиктік
формуласы:
Графиктік
формуласы:
1s2 2s2 3p6 3s1
Табиғатта кездесуі. Біздің ғаламшарымызда таралуы бойынша барлық элементтердің ішінде натрий алтыншы орын алады, оның үлесіне жер қыртысы массасының 2,64% - ы тиесілі. Натрий табиғатта тек қосылыс түрінде кездеседі, олардың көбісі адамзатқа ертеден белгілі. Ол жер қыртысында ас тұзының, далалық шпаттың және граниттің құрамына кіреді. Тау жыныстары мүжілгенде натрийдің ерімтал қосылыстары түзіледі, олар сумен бірге теңіздер мен мұхиттарға жетеді. Мұхит суларында 2,8% шамасында натрий хлориді болады, ішкі теңіздерде оның мөлшері оданда жоғарылайды. Ерте кезеңдерде теңіздердің жағасында болатын құбылысты осы кездері де Каспий және Арал теңіздерінің жағалауларынан байқауға болады. Суы азайған шығанақтар теңізден бөлініп, онда құрғақ ауа райының әсерінен су қарқынды буланып, теңіз тұзы концентрациялана түседі. Сөйтіп, шығанақтар бірте-бірте тұзды көлдерге айналады.Осындай көлдерде жүз мыңдаған жылдардың ішінде ас тұзының мол қоры жинақталады, оның минералын галит деп атайды. Қазақстанда көптеген тұзды көлдер мен тас тұзының қоры (галит) кездеседі. Олар натрий хлоридін өндірудің көзі болып табылады. Осындай қорлар көбіне Каспий маңы ойпатында, Арал теңізінің жағалауында, Ертіс өзенінің бойында кездеседі. Қазақстанда мирабилит деп аталатын минеалдың Na2SO4 ·10H2O кең орындары көп. Олардың ірілері Алматы, Қызылорда облыстарында шоғырланған.Натрийдің табиғи қосылыстарының ең маңыздысы – натрий хлориді адамға өте қажет. Ол адам мен жануарлар қорегінің құраушысы болып саналады, сонымен атом құрылысы 8- сыныпқа сай осылай беріледі.
Физикалық қасиеттері. Натрий басқа да сілтілік металдар сияқты, иондық кристалдық торлар түзеді. Мұндай торларға атом қабаттары бір-бірімен салыстырғанда өзара перпендикуляр 3 бағытта сырғи алады, осыған орай натрий иілімді әрі жұмсақ келеді. Ол пышықпен оңай кесіледі, созылады. Натрий судан жеңіл, тығыздығы 0,97 г/см3. Ол оңай балқиды: tбалқу = 97,7⁰С. Сұйық күйде жылу мен электр тоғын өте жақсы өткізеді, сондықтан оны ядролық реакторларда жылутасымалдағыш ретінде жиі пайдаланады. Жарықтың әсерінен натрий өз электрондарын оңай бөліп шығарады. Сілтілік металдардың бәрі керосин қабатының астында сақталады, өйткені олар ауаға бірден оксидтердің татымен қаптала бастайды. Осыған орай натрийге тән металдық жылтырды оны жаңадан пышақпен кескен жерінен байқауға болады. Натриймен жұмыс істегенде қауіпсіздік техникасының ережелерін сақтау қажет: оны қолмен ұстауға болмайды, өйткені күйдіреді. Натрий қалдығын раковинаға немесе қоқыс салған корзинаға тастай салуға болмайды, өйткені өзінен – өзі тұтануы немесе қопарылуы мүмкін.
Химиялық қасиеттері. Натрий өте белсенді металдардың қатарына жатады. Оның химиялық реакция кезіндегі өзгеруін былайша өрнектеуге болады:
Na0 - 1ē = Na+
Бұл процесс өте оңай жүреді, сондықтан натрий күшті тотықсыздандырғыш болып саналады. Ол іс жүзінде азот пен салғырт газдардан басқа барлық бейметалдармен әрекеттеседі. Натрий оттекте, фторда, хлорда жанады, ал күкіртпен араласып ұнтақтаса тұтанады:
2Na + S = Na2S
Натрийді суға салғанда онымен қуатты реакцияға түседі. Осы кезде бөлінген жылудың әсерінен металдың түйірі балқып, су бетінде ″жүгіре ″ бастайды.Натрий түйірін бөлінетін сутек газы итереді.
 2Na
+ 2H2O
= 2NaOH + H2
2Na
+ 2H2O
= 2NaOH + H2
 Na
- ē
- Na 1 2 тотықсыздандырғыш
Na
- ē
- Na 1 2 тотықсыздандырғыш
2H + 2ē - H2 2 1 тотықтырғыш
Егер металдың кесегі үлкен болса ол өзінен – өзі тұтанып, тіпті қопарылуы мүмкін. Бұл аса қауіпті сондықтан натрийді сумен әрекеттестірерде металдың кесегін бұршақтан кішілеу етіп алады әрі қауіпсіздік техникасы ережесін қатаң сақтайды. Натрийді тұздар мен қышқылдардың ерітінділеріне салу қауіпті, өйткені натрий, алдымен еріткіш - судың өзімен әрекеттеседі, яғни химиялық қасиеті осылай қарастырылады.
Натрий және оның қосылыстарын анықтау. Натрий иондары жалынды сары түске бояйды, бұл тым сезімтал реакция. Платина сымын алақанға бір сәт тигізіп, одан соң жанарғының жалынына апарсаң, бірден натрийге тән сары түс пайда болады. Бұл терлегенде алақанда қалған ас тұзындағы натрийдің әсері.
Өнеркәсіпте алу. Натрий өте белсенді тотықсыздандырғыш ретінде өзінің сыртқы электронын оп – оңай беретіндіктен, оған сол электронды қайта қосу тым қиынға түседі.Сондықтан бос күйіндегі натрий XIX ғасырдың басынды электр тоғы қолдаыла бастаған кезде алынды. 1807 жылы ағылшын ғаламы Дэви металл күйдегі натрийді натрий гидроксидінің балқымасын электролиздеу арқылы бөліп алды.Басқа сілтілік металдарды да осы күнге дейін олардың қосылыстарының балқымасын электр тоғымен ыдыратып алады:
 2NaCI
электр
тоғы 2Na
+ CI2
↑
2NaCI
электр
тоғы 2Na
+ CI2
↑
Қолданылуы. Металл күйдегі натрий қазіргі ғылым мен техникада сан алуан салада қолданылады. Натрийдің қолданылу сызбанұсқа түрінде беріледі [2].
Натрийдің қолданылуы
Авиация
мен ядролық реакторлардың жылу
тасымалдағышы
Органикалық
химияда өршіткі


Шамдарды
натрий буымен толтыру
Металлургиядағы
тотықсыздандырғыш




Медицинада
радиоктивті изотоптар
Көлікте
натрийдің қорғасынмен құймасы
2.2. 9-сыныпта металдар және оның қосылыстарының оқылытуы.
Бірінші химиялық элементтердің пероидтық жүйесіндегі металдардың орны, олардың атомдары мен кристалдарының құрылыс ерекшеліктерінен басталады. Бұнда металдар - химиялық элементтерді де, олар түзетін жай заттарды айтады деп анықтама беріліп, содан соң сипаттамаларына тоқталады. Химиялық элементтердің басым көпшілігі – металдар. Қазір белгілі болып отырған 110 элементтің 89-ы металдарға жатады. Химиялық элементтердің барлық топтарында металдар бар. Периодтық кестедегі металдар мен бейметалдарды өзара бөліп көрсету үшін II топтағы бериллийден VII топтағы астатқа қарай диагональ жүргізгенін білесіңдер. Сонда сызықтың жоғарғы жағында ( қосымша топша металдарын есептемегенде) бейметалдар, ал төменгі жағында металдар орналасады. Олар I-III топтың негізгі топшасында және барлық қосымша топшаларда кездеседі.Металл атомдарының өзіне тән ерекшеліктері бар. Диагональ сызықтың дел үстінде жатқан бериллий, алюминий сияқты металдар екіжақты қасиеті бар екідайлы элементтерді құрайды. I-III топ металдарына салыстырмалы сипаттама беріледі. I-III топтың негізгі топша элементтері s- және p- элементтерге жатады. Олардың сыртқы энергетикалық деңгейінде 1s немесе 2 s-электрон (I, II топтар) ненмесе 1р-электрон (s2 p1) ( III топ) болуы мүмкін. Химиялық әрекеттесу кезінде бұл металдар валенттік электрондарын жеңіл береді де, топ нөмірлеріне сәйкес +1, +2, +3 тұрақты тотығу дәрежелерін көрсетеді. -элементтер-металдардың типтік өкілдері. Периодттық жүйедегі әрбір период осындай металдардан басталады. Р-элементтердің металдық қасиеттері едәуір әлсіз болады. Топтағы элементтердің ядро зарядының өсуіне және иондану энергиясын кемуіне орай металдық қасиеттері артады. S-элементтер оттекпен негіздік сипаты бар R2O (Iтоп) және (II топ) оксидтер түзеді. Бұл оксидтер сумен әрекеттесіп сәйкес гидроксидтер – негіздер ROН және R(OH)2 түзеді. Негіздердің күші топ бойынша жоғарыдан төмен қарай металл атомы радиуысының өсуіне сай артады. III топтың p- элементтері құрамы R2O3 оксидтер түзеді, оларға R(OH)3 гидроксидтері сәйкес келеді. Топтағы қосылыстардың сипаты екідайлықтан негіздікке қарай өзгереді. Металдар периодтың басынан бастап орналасады, сондықтан олардың атомдарының радиусы бейметалдармен салыстырғанда үлкендеу келеді.Атом құрылысындағы мұндай ерекшеліктер тек металдарға ғана тән.Сонымен бұл жерде металдық байланыс қарастырылады. Жай зат түріндегі металдар кристалдар түзеді.Кристалға басы біріккен атомдардың арасында химиялық байланыстың ерекше түрі – металдық байланыс пайда болады. Кристалдық тордың түйіндеріндегі металл атомдарының радиуысы үлкендеу болатындықтан әрі сыртқы қабатындағы электрондар ядро мен әлсіздеу байланысқандықтан, олар оп-оңай үзіліп, атомдарды иондарға айналдырады.Керісінше металл иондары жетіспейтін электрондарды қайта қосып та алады. Мұндай қайтымды процессті былайша өрнектейді:
Ме0 - nē ↔ Меn+
Кристалдық тордың түйіндеріндегі атомдардан бөлінген электрондар оның барлық құрылымдық бөліктеріне ортақ күйге көшеді.Кристалды ішінде еркін орын ауыстыратын электрондар ондағы бүкіл атомдармен иондарды өзара байланыстырады. Мұндай кристалдың түйіндегі атомдар мен иондар арасында еркін қозғалыста болатын электрондарды «электрон газы» деп те атайды. Металдық байланыс дегеніміз – металдық кристалдық тор түйіндеріндегі атомдармен оң зарядталған иондар және электрон газы (бос электрондардан тұратын) арсында түзілетін байланыс теріс зарядталған ортақтасқан электрондардың жиынтығы оң зарядталған металл иондары – катиондарды және тордың түйіндеріндегі атомдарды өзара байланыстырып, берік ұстап тұрады. Осылайша металдық кристалдық тор пайда болаы деп қарастырылады. Енді металдардың физикалық қасиеттері оқытылады. Металл кристалындағы атомдар, иондар «электрон газымен» берік ұстасып, металдық байланыс түзеді дедік. Кристалдағы бос электрондарға тәуелді металдар булгілі бір ортақ қасиеттерге ие болады. Бұл қасиеттерге жылу және электрөткізгіштік, металдық жылтыр, иілімдік, т.б. қасиеттері жатады.
Электр - және жылуөткізгіштігі. Электр өрісінің әсерінен электрондар бағытты қозғалысқа ие болады, сөйтіп электр тогы пайда болады. Электрөткізгіштігі ең жоғары металдар күміс пен мыс, одан кейін алтын, алюминий, темір болып келеді. Ең аз электрөткізгіштік сыныпқа тән. Көптеген металдардың жылуөткізгіштігінің өзгеру реті электрөткізгіштігінің өзгеру ретімен сай келеді. Жылуөткізгіштік те элетрөткізгіштік тәрізді электрондардың қозғалғыштығына және кристалдағы бөлшкетердің тербелмелі қозғалысына тәуелді. Осы құбылыстардың арқасында металл кесегіндегі қызу бөлшектердің бірінен – біріне беріліп, өзара тез теңеседі. Мысалы, күміс қасықшыны стаканға қарағанда жылуды 500 еседей тез өткізеді деп қарастырылады.
Енді металдық жылтырына тоқталады. Бұл металдардың өзіне тән қасиеттерінің бірі - оны адамдар өте жоғары бағалап, кейбір көркем өнар туындыларын жасауға пайдаланады. Металдың бәрі де жылтырайды, бірақ мөлдір емес, өзіндік жылтыры бар. Олар көбіне сұр түсті болып келеді. Бұлай болу себебі металл кристалдарының ішіндегі бос кеңістікте электрондар бар, олар күн сәулесін жұтып тербеліске ұшырайды да, өзіне тән толқындар шығара бастайды, оған сәйкес түсті адам көзбен көреді. Металдар радио толқындарды да шағылыстырады, сондықтан оны металл денелерді анықтауға арналған радиолокацияда пайдаланылады. Осыдан кейін иірімділігіне көшеді.
Иірімділігі (пластикалығы). Металдарды соққанда, ұсақ түйіршіктерге бөлініп шашырап қалмайды, небәрі пішінін өзгертіп тапталады не жаншылады, яғни соғуға төзімді пластикалық қасиетін – иілімділігін көрсетеді. Олай болатын себебі, атомдар қабаттары металдық байланысты сақтай отырып бірінің бетінде бірі сырғып жылжи алады. Металл кесегіндегі электрондар, оның өне бойымен бірге қозғалып, сырғыған қабаттарды үнемі байланыстырып тұрады. Металдардың иілімділігі мынадай қатар бойынша кемиді: Au, Ag, Cu, Sn, Pb, Zn, Fe. Мысалы, алтынды таптап, қалыңдығы 0,003 мм жұқа қабықшаға айналдыруға болады. Оны әртүрлі денелерге алтын ″ жалатқанда ″ қолданады. Енді балқу температуралары оқытылады. 1000⁰ С-тан жоғары температурады балқитын металдарды қиын балқитындар, ал одан төмен болса, оңай балқитындар деп бөлінеді. Ең оңай балқитын металл – сынап, оның балқу температурасы – 38,9⁰ С. Ең қиын балқитын металл – вольфрам, оның балқу температурасы tб⁰ = 3390⁰ С, сондықтан оны электр шамының сымын дайындау үшін қолданады.
Тығыздығы. Металдардың тығыздығы 5 г/см3 – тен аз болса, жеңіл, ал одан асса, ауыр металдар деп бөлінеді. Ең жеңіл металл – литий, ол судан 2 еседей жеңіл. Ең ауыр металл – осмий , оның тығыздығы судан 22 еседей үлкен. Тығыздығы аз жеңіл металдар, мәсклен, Mg, Al, Ti ғарыш кемесі, ұшақ, автомобиль жасауда қолданылады.
Қаттылығы. Металдардың қаттылығы да әрқилы. Сітілік металдар өте жұмсақ, оларды пышақпен оңай кесуге болады. Ал хром, вольфрам сияқты металдарды өңдеу өте қиын, өйткені олар тым қатты болып келеді, сондықтан кесетін құралдар жасау үшін қолданылады. Хром – ең қатты металл. Металдардың бұл қасиеттері периодтық жүйедегі орнына байланысты. Кіші период бойынша және үлкен периодтардың жұп қатарында металдардың қаттылығы, балқу температурасы, ядро зарядының және валенттік электрон санының өсуіне байланысты тығыздығы артады, ал негігі топшада кемиді. Енді келесі тақырыпта Металдардың электрохимиялық кернеу қатары оқытылады.
Металдардың химиялық қасиеттері олардың атомдарының құрылысына, яғни атом радиусының үлкендеу, валенттілік электрондар санының аздау болатынына тәуелді. Реакция кезінде металл атомдары өздерінің валенттілік электрондарын оңай береді, сөйтіп оң зарядты катиондарға айналып тотығады:
Ме0 - nē = Меn+
Металл атомдары барлық уақытта тотықсыздандырғыш қызметін атқарады, ал тотықтырғыш қызметін металл атомдары берген электрондарды қосып алатын атомдар немесе иондар атқарады. Осыдан кейін химиялық қасиеттері өтіледі.Ол 1- кестеде келтірілген.
1 – кесте
Металдар – тотықсыздандырғыштар |
|
Қосылу реакциялары |
Орынбасу реакциялары |
Бейметалдармен әрекеттесуі: а) оттекпен: 2Mg + O2 = 2MgO ә) күкіртпен: 2Al + 3S = Al2S3 б) галогендермен: 2Na + Cl2 = 2NaCl
|
Күрделі заттармен әрекеттесуі: а) сумен: 2Li + 2HOH = 2LiOH + H2 ↑ ә) оксидтермен: 2Al + Fe2O3 = 2Fe + Al2O3 б) қышқылдармен: Zn + H2SO4 = ZnSO4 + H2↑ в) тұздармен: Fe + CuSO4 = FeSO4 + Cu |
Металдардың тотықсыздандырғыштық қабілеті бірдей емес. Мәселен, натрий оттекпен бірден әрекеттеседі, ал мыс оттекпен қыздырғанда ғана реакцияласады. Ал тотияйының CuSO4 ерітіндісіне батырылған темір шеге қызғылт түсті мыспен қапталады, керісінше темір сульфатының FeSO4 ерітіндісіне салынған мыс шеге өзгермейді. Мыспен салыстырғанда темірдің электрондары атомдапдан оңай үзіледі, өйткені темір – мыстан гөрі белсендірек элемент. Орыс ғалымы Н.Н. Бекетов металдардың сулы ерітіндідегі тотықсыздандырғыш қабілетінің әртүрлі екендігін эксперимент жүзінде анықтай отырып, 1865 жылы металдардың белсенділік қатырын ұсынды және бұл қатарға сутекті енгізді. Қазір оны металдардың электрохимиялық кернеу қатары деп атайды:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
Металдардың тотықсыздандырғыш қасиеті
артады ← → кемиді
Металдардың белсенділігі сол металдың тақташасын өз тұзына батырғанда туатын кернеумен анықталады. Сулы ортада жүретін тотығу - тотықсыздану реакциясы кристалдық тордың бұзылу энергиясына, атомнан электронды үзіп алу энергиясына, иондардың гидраттану энергиясына тәуелді. Сондықтан металдардың электрохимиялық кернеу қатарында периодтық жүйедегі ең белсенді металл – францийдің орнын литий алып тұр. Металдардың электрохимиялық кернеу қатарындағы орнына сәйкес шығатын заңдылықтар көптеген химиялық процесстердің бағытын табуға көмектеседі. Кейбір осындай заңдылықтар 2- кестеде келтірілген.
2-кесте
Li K Ca Na Mg Al Zn Cr Fe Ni Sn Pb/H/ Cu Hg Ag Pt Au |
||
Атомдардың тотықсыздандырғыш қабілеті артады |
||
Кәдімгі жағдайда тотығады |
Қыздырғанда тотығады |
Қыздырғанда да тотықпайды |
Сумен кәдімгі жағдайда әрекеттеседі, Me(OH)n және Н2 түзіледі |
Сумен қыздырғанда әрекеттеседі, MemOn және Н2 түзіледі |
Сумен әрекеттес- пейді |
Қышқылдармен (концентрлі H2SO4 және HNO3 – тен басқалары )H2 бөле әрекеттеседі: Me0 + 2H+ = Me+n + H02 |
Қышқылдармен (концентрлі H2SO4 және HNO3 – тен басқалары ) әрекеттеспейді |
|
Белсендірек металл өзінен белсенділігі төмен металды тұздарының ерітіндісінен ығыстырып шығарады: Me1 + Me2 = Me1 + Me2 |
||
Табиғатта тек қосылыстар түрінде кездеседі (тұздар мен оксидтер) |
Табиғатта қосылыстар түрінде де, бос күйінде де кездеседі |
|
Металдардың кернеу қатарын қолданғанда, олардың қасиеттеріндегі кейбір ерекшеліктерді есте сақтау керек. Мысалы ең белсенді металдар - Li, K, Na, Ca, Sr, Ba белсенділігі төмендеу металдардың судағы ерітідісінен оларды ығыстырып шығаруға қолданылмайды, себебі сілтілік және сілтілік жер металдар кәдімгі жағдайда судың өзімен қарқынды әрекеттесетіні белгілі. Осыдан кейін металдардың адам өміріндегі маңызы өтіледі. Металдар адамзат қоғамына ерте заманнан белгілі. Өркениетті өндірістің дамуына сәйкес және адамдардың металдарды игеруі мен қолданылкына орай тарихта бүтіндей металл дәуірлерінің аты қалды. Геология мен металлургияның негізін салған, металдарды зерттеуші Георгий Агрикола XVI ғасырда былай деп жазды: ″Адамдар металдарсыз өмір сүре алмайды... егер металдар болмаса... адамдар жабайы аңдардың арасында ең аянышты өмір сүрген болар еді″. Тас ғасырында – ақ алғашқы табылған металдар сом күйдегі тума алтын мен күміс болатын. ″Металдар″ деген сөздің өзі ертедегі гректің осыған үндес ″іздеу″ деген сөзінен шығуы мүмкін. Адам алғаш рет таза темірмен аспаннан түскен метеориттің сынығы арқылы танысты.Темірді балқытып бөләп алудың құпиясы біздің заманымызға дейінгі 1500 жылдарда Кіші Азияда ашылды, содан бастап темір дәуірі басталды. Металдар қосылыстарының литосфера мен биосферадағы орны. Қазіргі адамзат қоғамының дамуы үшін металдардың маңызы орасан зор. Бүгінгі күндері таңғажайып қасиеттері бар синтетикалық заттардың сан алуан түрі өндірілмегеніне қарамастан, металдар осы заманғы техникаға қажетті ең маңызды конструкциялық материал болып отыр. Олар автомобильдердің, ұшақтардың, зымырандардың, станоктардың, өте дәл құралдардың және электрондық техниканың негізі болып саналады. Металдар – құрылыстың, технологиялық конструкциялардың, химиялық реакторлардың, құбырлардың, мұнай өндіретін мұнаралардың және т.б. негізгі өзегі.Қазіргі кезде техникада 40 – тан астам металдар кеңінен қолданылады. Металдар – жай заттар ған емес, олар химиялық элементтер.Осы элементтер тірі және өлі табиғаттың аса маңызды құрамдас бөлігі болып табылады. Осы тақырыптан кейін жеке тақырып болып кальций металы қарастырылады.
Атом құрылысы. Кальций сілтілік металдардан кейін тұр. Ол II топтың негізгі топшасында орналасқан сілтілік жер металдардың қатарына жатады, олар суда ерігенде сілтілер түзеді. Кальций атмоының сыртқы энергетикалық деңгейінде 2 электрон бар:
+20Ca ) 2ē ) 8ē ) 8ē ) 2ē
Кальций атомының электрондық формуласы: 1s2 2s2 2p6 3s2 3p6 4s2
Табиғатта кездесуі. Кальцийдің қосылыстары табиғатта кең таралған. Ол жер қыртысындағы мөлшері бойынша бесінші орын алады, ал массасы бойынша 3,6%. Табиғатта оның қосылыстарын кез келген жерде кездестіруге болады, өйткені тау мен сары топырақты қазбалар кальций тұздарынан құралған. Ол теңіз бен өзен суларында да кездеседі, өсімдік пен жануар организмінің құрамына кіреді. Адам организмінде 1 кг- ға дейін кальций бар, ол сүйектің, тіс эмальнің, қанның құрамында болады. Табиғатта ең көп таралған – кальций карбонаты. Ол алуан түрлі минералдар түзеді: бор, мәрмәр, әктас, ұлу тас, кальцит, маржандар, т.б. аралас минералдар. Қазақстан жерінің бәрінде дерлік кальций қосылыстары кең таралған. Фосфориттің ең ірі кен орындары Жамбыл облысындағы Қаратау тауларында, Ақтөбе облысындағы Шилісайда бар. Бағалы қызғылт түсті ұлутас Маңғыстауда, гипс Жамбыл облысында, цементке қажетті балшық Шымкент, Семей маңында өндірілсе, әктастың қоры және отқа төзімді балшық еліміздің көптеген облыстарында өндіріледі. Физикалық қасиеттері. Кальций – күміс түстес, ақ, жеңіл металл. Оның тығыздығы 1,54г/см3. Сілтілік металдардың тығыздығына жуық. Кальций ауамен тез әрекеттесіп, тотығу өнімдерінен тұратын кеуектеу жұқа ақ қабықшамен қапталады, сондықтан оны сілтілік металдар сияқты керосин қабатының астында сақтайды. Кальций – қатты металл, оның балқу температурасы 851⁰ С. Химиялық қасиеттері. Химиялық белсенділігі бойынша кальций сілтілік металдардан кейін тұрады. Ол белсенді тотықсыздандырғыш:
Ca0 - 2ē = Ca+2
Кальйийдің қосылыстардағы тотығу дәрежесі тұрақты +2. Ол әртүрлі бейметалдармен әрекеттеседі:
Ca0 + S0 = Ca+2S-2
3Ca + N2 = Ca3N2
Ауада қыздырғанда тұтанады, ал таза оттекте ашық жалынмен жанып, кальций оксидінің бөлшектерінен ақ түсті түтін түзеді:
2Ca + O2 = 2CaO
Белсенді металл ретінде кальций күрделі заттармен де реакцияға түседі. Мәселен, сумен қуатты әркеттесіп, одан сутекті ығыстырып шығарады:
Ca + 2H2O = Ca(OH)2 ↓ + H2↑
Кальций және оның қосылыстары жалынның түсін кірпіш қызыл түске бояйды. Алынуы. Өнеркәсіпте кальцийдің сілтілік металдар сияқты, тұздарының балқымасын электролиздеу арқылы алады:
 CaCl2
электр
тоғы
Ca + Cl2
↑
CaCl2
электр
тоғы
Ca + Cl2
↑
Қолданылуы. Кальцийді тотықсыздандырғыштық қабілетіне бола өнеркәсіпте кейбір бағалы металдарды (Ti, V, Be, U,т.б. ) алу үшін қолданады. Мысалы:
Ca + BeO = CaO + Be
Осы тақырыптан кейін кальцийдің қосылыстары өтіледі. Кальций оксиді – ақ түсті қиын балқитын зат. Техникада оны ″сөндірілмеген әк ″ деп атайды. Оны әктасты жоғары температурада (1000⁰ С шамасында ) қыздырып, ыдырату арқылы алады:
СаСО3 = CaO + CO2 ↑ - 180 кДж.
Кальций оксиді – нағыз негіздік оксид. Кальций сілтілік жер металл болғандықтан, оның оксиді сумен оңай әрекеттесіп кальций гидроксидін, яғни сілтісін түзеді.
CaO + H2O = Ca(OH)2 + 70кДж.
Бұл реакция өте қуатты жүреді: су бұрқылдап қайнап жатады, тіпті біразы буланады. Нәтижесінде сөндірілген әк деп аталатын көпсіген кеуек – ақ ұнтақ түзіледі. Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі зертханада әк суы деген атпен жиі қолданылады. Кальций гидроксиді ерітіндіде иондарға толық диссоцияланады:
Са(ОН)2 = Са+2 + 2ОН-
Табиғатта кальций қосылыстарының айналымы. Табиғатта жүретін көптеген процестер кальций тұздарымен байланысты болады.Осындай процестің моделі ретінде жоғарыда қарастырылған кальций карбонатының гидрокарбонатқа айналуын және оған кері реакцияларды алуға болады. Жаңбыр және басқа да табиғи сулпр ауадағы көмірқышқыл газын ерітіп, көмір қышқылын түзеді:
H2O + CO2 ↔ H2CO3
Осыдан кейін алюминий металы қарастырылады. Алюминий - III периодтың, III тобының элементі. Негізгі топшаның өкілі ретінде бейметалл бор мен металл галлийдің арасында орналасқан. Период бойынша алғанда да алюминий бейметалл кремний мен металл магнийдің ортасында тұр. Міне, осылайша орналасуы оның қасиеттерінен де көрінеді. Жай зат ретінде алюминий металл болғанымен, химиялық элемент ретінде екідайлы қасиет көрсетеді, өйкені екідайлы оксид пен гидроксид түзеді.
Атом құрылысы. Алюминий атомның сыртқы қабатында 3 электрон бар:
+13Al ) 2ē ) 8ē ) 3ē
Алюминий атомының электрондық формуласы:
1s2 2s2 2p6 3s2 3p1
Г рафиктік
формуласы:
III ↑↓ ↑
рафиктік
формуласы:
III ↑↓ ↑
II↑↓ ↑↓ ↑↓ ↑↓
I ↑↓
S P
Ол қосылыстарында тұрақты 3 валенттік және +3 тотығу дәрежесін көрсетеді. Табиғатта кездесуі. Алюминий табиғатта таралу бойынша элементтер арасында оттекпен кремнийден кейінгі 3 орында тұр (масса бойынша 8,8%). Табиғаттағы металдарлың ішінде ол таралу бойынша 1 орынды алады. Белсенді металл болғандықтан, алюминий тек қосылыстар түрінде кездеседі. Жер қыртысының негізгі массасын алюмосиликатттар құрайды. Олардың құрамын алюминий, оттек, кремний, сілтілік және сілтілік жер металдар кіреді. Физикалық қасиеттері. Алюминий – күміс түстес ақ металл. Оның кристалдық торы көлемді орталықтанған куб. Сондықтан ол жеңіл ( тығыздығы 2,7 г/см3 ), өте иілімді және жұмсақ. Электр – және жылуөткізгіштігі өте жоғары (күміспен мыстан ған кем). Металдардың арасында қайнау температурасы (650⁰ С) әжептеуір төмен деп есептеледі. Ол басқа металдармен құймаларды оңай түзеді. Химиялық қасиеттері. Күнделікті өмірде алюминий ыдыста су қайнатып, тамақ пісіріледі. Сонда алюминий оттекпен және сумен әрекеттеспейтіндей белсенділігі төмен металл болғаны ма? Белсенділік қатарында ол сутектен әлдеқайда солға қарай орналасқан, демек, ол белсенді металл (күшті тотықсыздандырғыш) болуға тиісті. Мұндай қайшылық былайша түсіндіріледі. Металдың беті ауаудағы оттекпен жанасқанда лезде тотығып, оксидті қабықшамен қапталады:
4Al + 3O2 = 2Al2O3
Алюминийдің бетіндегі Al2O3 қабықшасының қалыңдығы 0,00001 мм, ол өте берік, иілімді. Өнеркәсіпте алынуы. Өндірісте жер балшықтан тазартылған алюминий оксидіне Al2O3 натрий – алюминий фторидінің қоспасын қосып электролиздеу арқылы алады:
 2Al2O3
элекр
тоғы
4Al + 3O2
- 3352 кДж
2Al2O3
элекр
тоғы
4Al + 3O2
- 3352 кДж
Қолданылуы. Алюминийдің физикалық және химиялық қасиеттері оны осы заманғы техникада кеңінен қолдануға мүмкіндік береді. Таза күйінде оны электро – техникада пайдаланады. Алюминийдің электроөткізгіштігі мысқа қарағанда төмендеу, бірақ ол мыстан 3 есе жеңіл. Сондықтан электркедергісі мысқа пара – пар болатындай алюминийдің массасы одан 2 есе аз болады. Таза алюминий тамақ өнеркәсібінде жұқа орағыштар (жұқалтырлар) ретінде көп пайдаланылады. Енді темір металы тура осындай түрде табиғатта кездесуі, биологиялық маңызы, физикалық қасиеттері, химиялық қасиеттері, алынуы және маңызды қосылыстары өтіледі.Келесі тақырып металдардың жемірілуі және онымен күресу жолдары оқытылады. Металдар мен құймалар әртүрлә заттармен жанасқанда олармен әрекеттесіп, химиялық қосылыстар түзеді. Әсіресе жаңбыр, топырақ ылғалы, ауа әсерінен қоршаған ортадағы металдар бөлініп желінеді.Қоршаған орта факторлары әсерінен болатын металдың желіну құбылысы жемірілу (коррозия) деп аталады. Металдардың бәрі бірдей жемірілуге ұшырай бермейді. Кернеу қатарында күмістен соң орналасқан металдар «бекзат металдар» деп аталады, олар іс жүзінде бүлінбейді. Кернеу қатарының орта шеңінде жемілуге баяу ұшырайтын металдар орналасқан. Олардың біразы мысалы, магний, мырыш, алюминий, хром, никель жемірілуге төзімді, себебі металдардың бетінде оксидпен тұратын өте жұқа қабықша пайда болып, металдарды қоршаған ортамен жанасудан сақтап тұрады. Адамдар темірдің таттануын жиі кездестіреді, жемірілген темірдің бетін кеуек қоңырқай тат қабаты басады. Электрохимиялық жемірілу жиірек кездеседі. Электрохимиялық жемірілудің басты себебі – электролит ерітінділерінің болуы. Жемірілуімен күресу жолдары. Бүкіл әлемде адамның белсенді іс әрекетінің нәтижесінде қоршаған ортаның ластануы шекті деңгейге жетіп отыр, осыған орай металдар мен құймалардың жемірілуі де күшейіп келеді.Қазір ғылым мен практика жемірілу процесін шектеудің, азайтудың, тіпті мүлдем болдырмаудың көптеген әдіс –тәсілдерін ұсынады. Жалпы алғанда, жемірілумен күресудің бірнеше бағыттары сызбада көрсетілген.


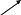






Осыдан кейін Табиғаттағы металдар. Қазақстанда кендерден металл алу тақырыбы өтіледі. Жер қыртысында металдардың таралуы әртүрлі. Металдар табиғатта көбінесе қосылыстар түрінде кездеседі. Белсенділігі тым төмен металдар ( купрум, аргентум, аурум, плптина) ғана сом күцінде кездеседі. Кернеу қатарындағы литийден магнийге дейінгі орналасқандары – ең белсенді металдар. Олар табиғатта тұздар: хлоридтер, сульфаттар, кабонаттар, фосфаттар әсіресе силскаттар түрінде кең таралған. Орташа белсенділігі бер металдар (магнийден сынапқа дейін) жер қыртысында көбіне оксидтер мен сульфидтер түрінде кездеседі, бірақ олардың тұзтектес минеалдары да бар. Өнеркәсіптік әдіспен металдар алынатын минералдарды кендер деп атайды. Егер кеннің құрамында бірнеше металдың қосылыстары кездессе, оларды полиметалл кендерге жатқызады. Қазақстанда кендерден металл өндіру. Қазақстанның жер қойнауында қорғасынды, мысты, мырышты, т.б. полиметалл кендер өте көп. Мамандардың айтуынша, біздің республикамызда периодтық жүйедегі барлық элементтердің жерде кездесетін қосылыстары бар. Мәселен, Алтай тауларының Қазақстанға қарасты жағында 900-ге жуық полиметалл кен орындары табылған. Осыған бола бұл өлке Кенді Алтай деп аталады. Жезқазғанда мыс, қорғасын, мырыш, никель, кобальт, алюминий, марганец, т.б. металдардың кендері кездеседі. Қаратау жоталарында да қорғасын, мырыш, ванадий, темір кендері көптеп кездеседі. Қазақстандағы кен орындарын зерттеумен академик Қ. И. Сәтбаев бастаған ғалымдар тобы айналысты. Және де соңында металдар тақырыбына эксперименттік есептер шығару беріледі [ 3].
Құралдар мен реактивтер: Сынауықтар, тұрғы және есептің әр нұсқасына сәйкес реактивтер.
I нұсқа
Темір (III) хлориді, алюминий хлориді, кальций хлориді ерітінділерінің әрқайсысы қай сынауықта екенін анықтаңдар.
Темір (II) сульфаты, натрий сульфаты, алюминий сульфаты, ерітінділерінің әрқайсысы қай сынауықта екенін анықтаңдар.
Мына сызбанұсқа бойынша
CaO → Ca(OH)2 → CaCl2
Кальций оксидінен кальций хлоридін алыңдар.
II нұсқа
Темір (II) хлориді, кальций хлориді, алюминий хлоридтері ерітінділерін бір реактивпен анықтаңдар.
Темір (III) хлориді, натрий сульфаты, алюминий сульфаты ерітінділерін бір реактивпен анықтаңдар.
Төмендегі айналымдарды тәжірибе жүзінде іске асырып, химиялық реакция теңдеулерін жазыңдар:
Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCO3
2.3 10- сынып бойынша металдардың қосылыстарының өтілуі.
Ал, 10 – сыныпта Металдар және оның қосылыстары тарауында металдардың жалпы қасиеттері, металдар мен бейметалдардың қасиеттерін салыстыру тақырыбынан басталады. Элементтер сыртқы белгілерімен қасиеттері бойынша металдар және бейметалдар деп бөлінеді. Олардың маңызды сипаттамалары қарастырылады.
Негізгі және қосымша топша металдары. Барлық металдардың қасиеттері бірдей емес. Периодтық жүйенің негізгі және қосымша топшаларында орналасқан металдардың құрылысы әртүлі, демек, қасиеттеріде әр түрлі болады.
I-III топтың негізгі топша элементтері s – және p – топшаға жатады. Олардың сыртқы энергиялық денгейінде 1s немесе 2s – электрон ( I, II топтар ) не 1p – электрон ( III топ ) болады. Химиялық әрекеттесу кезінде бұл металдар валенттік электрондарын жеңіл береді де, топ нөмірлеріне сәйкес +1, +2, +3 тұрақты тотығу дәрежелерін көрсетеді. S – элементтер – металдардың типтік өкілдері олармен периодтық жүйедегі (біріншіден басқасы ) әрбір период басталады. Р – элементтердің металдық қасиеттері едәуір әлсіз болады. Топтарда ядро заряды өсуіне және иондану энергиясы кемуіне орай, элементтердің металдық қасиеттері заңды күшейеді. S- элементтер оттекпен негіздік сипаты бар R2O (I топ ) және RO (II топ) типті оксидтер түзеді. Бұл оксидтер сумен әрекеттесіп, гидроксидтер – негіздер ROH және R(OH)2 түзеді. Негіздердің күші – топты жоғардан төмен қарай металл атомы радиусының өсуіне сай артады. III топтың p – элементтер құрамы R2O3 оксидтері түзеді R(OH)3 гидроксидтері сәйкес келеді. Топтағы қосылыстардың сипаты екідайлықтан негіздікке қарай өзгереді. Қосымша топша металдары негізгі топшалардың металдарынан құрылысы және қасиеттері бойынша ерекшеленеді. Енді сілтілік металдарға тоқталады. Сілтілік металдардың атаулары сумен белсенді әрекеттескенде сілті түзуіне байланысты алынған. Сілтілік металдар IA тобын түзеді.Бұл топқа алты металл: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr жатады. Натрий және калий қосылыстары ерте кезден бері белгілі болған, бірақ бұл металдар жеке күйінде ағылшын химигі Г.Дэви және неміс химигі Р. Бунзен жұмыстарының нәтижесінде 19 ғасырда ғана алынған. Атомдардың құрылысы. Олардың сыртқы энергетикалық денгейлерінде бір-бірден электрон бар. Сондықтан натрий және калий, барлық басқа сілтілік металдар сияқты өздерінің валенттік электрондарын жеңіл береді, өте күшті тотықсыздандырғыштар және өздерінің периодтарында өте белсенді металдар (қосылыстарында тотығу дәрежесі +1) болады.
K
1s2 2s2 2p6 3s2 3p6 4s1
Графиктік формуласы:
IV ↑
 III
↑↓
↑↓↑↓↑↓
III
↑↓
↑↓↑↓↑↓
II ↑↓ ↑↓↑↓ ↑↓
I ↑↓
S p
Элементтік реттік нөмері артқанда:
а) ядродағы протондар және атом қайызындағы электрондар саны артады;
ә) атомның энергетикалық деңгейінің саны артады;
б) атомдық және иондық радиустары артады;
в) элементтердің электртерістігі кемиді.
IA топ металдарының сипаттамасы 3-кесте
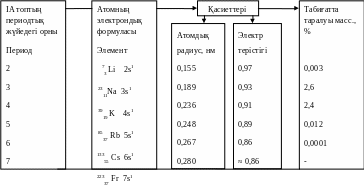
1 нм (нанометр) = 1· 10-9
Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе, кристалдық тор құрылысының ерекшелігіне тәуелді. Олардың барлығы басқа типті торға қарағанда тығыздығы аздау кубтық көлемді центрлі тор типі бойынша кристалданады. Атомдық қабаттар мұндай кристалда бір-біріне қатысты өзара үш перпендикуляр бағытта сырғуы мүмкін, сондықтан сілтілік металдар өте иілгіш, жеңіл болып келеді. Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде), жұмсақ (литийден басқасы пышақпен кесіледі). Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балқиды) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді. Барлық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Сілтілік металдардың қасиеттері 4-кесте
|
Жай заттар |
||||
|
Li(қ) |
Na(қ) |
K(қ) |
Rb(қ) |
Cs(қ) |
Кристалдық тордың түрі |
Көлемдік орталықтанған металдық |
||||
Тығыздығы, г/см3 |
0,53 |
0,97 |
0,86 |
1,53 |
1,87 |
Қаттылығы (шартты бірлік) |
0,6 |
0,5 |
0,4 |
0,3 |
0,2 |
Балқу температу-расы, С⁰ |
179,5 |
97,7 |
63,5 |
38,7 |
28,5 |
Қайнау температу-расы, С⁰ |
1340 |
883 |
776 |
713 |
690 |
Химиялық элементтері. Химиялық қасиеттері бойынша сілтілік металдар бір-біріне өте ұқсас. Олар - ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық белсенділігі Li-ден Cs-ге қарай өседі, өйткені кристалдағыхимиялық байланыстың беріктігі және катиондардың түзілу мен атомнан электронды үзіп алуға қажетті энергия кемиді. Бұл процесті сызбанұсқамен былай жазады:
K0 – 1 ē → K+
Бұл процестер өте жеңіл жүреді, бірақ калий – күшті тотықсыздандырғыш. Сілтілік металдар барлық бейметалдармен, сонымен қатар сумен, қышқылдармен әрекеттеседі (пероксидтер – сутек оксидінің H2O2 тұздары):
K + O2 = KO2
Бұл өтк қауіпті реакция, сондықтан натрийдің сумен реакцийсы үшін бұршақтан кіші металл кесегін алады. Суға салынған калий бірден тұтанады. Натрий және калийдің тұздар мен қышқылдардың сулы ерітінділерімен әрекеттесуі де қауіпті. Бірінші кезекте, олар сумен әрекеттеседі. Қышқылдармен реакция өте шабытты жүреді, калийде қопарылыс беруі мүмкін:
K0 + 2H3O+ = K+ + H2↑ + 2H2O
Сілтілік металдардың маңызды қосылыстары. Калий мен натрий ауада жанғанда кәдімгі оксидтерге Na2O және K2O қарағанда құрамында оттек көбірек қосылыстар түзеді:
2Na + O2 = Na2O2
Натрий пероксидінің құрамында пероксотоп (-О-О-О)-2 бар, мұндағы оттектің тотығу дәрежесі О-1 (″Пероксид″ сөзі ″кәдімгі оксидке қарағанда оттек көп″ болатынын білдіреді). NaOH және KOH гидроксидтері – типтік күшті негіздер. Бұлар ауада балқи бастайтын, ылғал тартқыш, ақ түсті кристалдық заттар. Олар суда жақсы ериді, толығымен диссоцияланады:
NaOH ↔ Na+ + OH-
KOH ↔ K+ + OH-
Қ
 ұрамында
гидроксид ионының ОН-
болуына байланысты сілтілердің
ерітінділері сабын тәрізді сезіледі,
олар теріні, матаны, қағазды (қолды,
әсіресе көзді байқау керек) деп жібереді.
Натрий және калий гидроксидтері –
негіздердің барлық қасиеттерін көрсетеді:
ұрамында
гидроксид ионының ОН-
болуына байланысты сілтілердің
ерітінділері сабын тәрізді сезіледі,
олар теріні, матаны, қағазды (қолды,
әсіресе көзді байқау керек) деп жібереді.
Натрий және калий гидроксидтері –
негіздердің барлық қасиеттерін көрсетеді:
+ HCI = NaCI + H2O OH- + H+ → H2O
қышқыл
+ CuSO4 → Cu(OH)2↓ + Na2SO4 2OH- + Cu2+ → Cu(OH2)↓
NaOH тұз
+ CO2 → Na2CO3 + H2O 2OH- + CO2 → CO32- + H2O
Натрий гидроксидінің техникалық атауы – күйдіргіш натр. Бұл химиялық өнеркәсіптің маңызды өнімі. Ол сабын, қағаз, жасанды талшық алу үшін, мұнай өнімдерін тазалауда бояу және дәрі-дәрмек алуда, сонымен бірге тұрмыста (каустикалық сода) қолданылады. Калий гидроксиді – күйдіргіш кали едәуір күшті сілті, бірақ қымбат өнім болғандықтан сирек пайдаланылады. Ауада қатты күйінде NaOH және КОН ылғалды қатты сіңіреді, сондықтан газдарды кептіру үшін қолданады. Натрий мен калий барлық қышқылдармен тұздар түзіп әрекеттеседі. Натрий мен калийдің тұздары – түссіз суда еритін заттар, оларды көбінесе техникада және тұрмыста қолданады. NaCI – ас тұзы тамаққа қосылады. Ол консервілеуші зат, зең саңырауқұлақтары мен шіріткіш бактерияларды жояды. Натрий хлоридін көп мөлшерде химия өнеркәсібінде: натрий, хлор, натрий гидроксиді, сода алу үшін шикізат ретінде қолданады. Na2SO4 – натрий сульфатыншыны, сода өндіруде қолданады. Судағы ерітінділерінен медицинада қолданатын глаубер тұзы деп аталатын Na2SO4 ·1OH2O кристалгидрат бөлінеді. Na2CO3 – натрий карбонаты, кальцийленген сода. Ол сабын қайнатуда, мата, тері, шыны, дәрі-дәрмек өндірісінде қажет. Осыдан кейін барып, топтың негізгі топша металдарының жалпы сипаттамасы өтіледі. Бериллий, магний, кальций, стронций, барий және радий периодтық жүйенің IIA тобын түзеді. Соңғы төрт металл сілтілікжер металдар топшасын құрайды. Бұлай аталу себебі олардың оксидтері алхимия кезеңінде ″жер″ деп аталған, ал оларды суда еріткенде сілтілер алынған. Магний, кальций, стронций, барийді – таза күйінде ағылшын химигі Г. Дэви 1808 ж., бериллийді – металл түрінде 1828 ж. Неміс химигі Ф. Вёлер, сондай-ақ радиоактивті металл радийді – 1910 ж. Француз химиктері П. Кюри мен М. Кюри алған. Атомдардың құрылысы және химиялық белсенділігі. Бұл топшаның барлық өкілдері – s-элементтері.
