- •2 Негізгі таратылатын материалдар мазмұны
- •2.1 Курстың тақырыптық жоспары
- •1Бөлім Механика
- •1 Кинематика
- •Материялық нүкте қозғалысының кинематикалық сипаттамалары
- •1.2 Траектория, жол ұзындығы, орын ауыстыру векторы
- •1.3 Жылдамдық
- •1.4 Үдеу және оның құраушылары
- •1.5 Қатты дененің ілгерілмелі қозғалысы
- •1.6 Айналмалы қозғалыс кинематикасы
- •Қатты дененің ілгерілмелі қозғалысының және материялық нүктенің динамикасы
- •2.1 Ньютонның бірінші заңы – инерция заңы
- •2.2 Күш. Масса
- •2.3 Ньютонның екінші заңы– материялық нүкте динамикасының негізгі заңы
- •2.4 Ньютонның үшінші заңы
- •2.5 Қатты дененің ілгерілмелі қозғалыс динамикасының негізгі заңы
- •2.6 Импульстің сақталу заңы
- •2.7 Механикалық жүйенің массалар центрі және оның қозғалыс заңдары
- •2.8 Механикадағы күш түрлері
- •2.9 Энергия, күш жұмысы, қуат
- •2.10 Денелер жүйесінің механикалық энергиясы
- •2.11 Механикалық энергияның сақталу заңы
- •3 Қатты дененің айналмалы қозғалыс динамикасы
- •3.1 Күш моменті
- •3.2 Дененің инерция моменті
- •4.1 Айналмалы қозғалыстағы дененің жұмысы және кинетикалық энергиясы
- •4.2 Қатты дененің айналмалы қозғалыс динамикасының негізгі теңдеуі
- •4.3 Импульс моменті және оның сақталу заңы
- •4.3 Импульс моментінің сақталу заңын дәлелдеу
- •Арнайы салыстырмалы теорияның элементтері
- •Релятивистік динамика элементтері
- •5 Тұтас орта механикасының элементтері
- •5.1 Ағынның үздіксіздік теңдеуі
- •5.2 Бернулли теңдеуі
- •5.2.1 Сұйықтықтың горизонталь ағуы
- •5.2.2 Сұйықтықтың тесіктен ағуы
- •5.3 Тұтқырлық
- •5.4 Сұйық ағынының екі түрі
- •Тербелістер мен толқындар
- •6.1 Механикалық гармониялық тербелістер және олардың сипаттамалары
- •6.2 Гармониялық тербелістегі материялық нүкте энергиясы
- •6.3 Гармониялық осцилляторлар
- •6.3 Өшетін тербелістер
- •6.4 Еріксіз тербелістер
- •6.5 Механикалық гармониялық толқындар
- •6.6 Жазық қума толқынның теңдеуі
- •6.7 Тұрғын толқындар
- •II бөлім . Молекулалық физика және термодинамика
- •7 Термодинамикалық жүйелер мен олардың параметрлері
- •7.1 Термодинамикалық параметрлер мен процестер
- •7.2 Идеал газдың күй теңдеуі
- •7.3 Идеал газдардың молекула-кинетикалық теориясы
- •7.4 Газ молекулаларының ілгерілемелі қозғалысының орташа кинетикалық энергиясы
- •7.5 Статистикалық таралу
- •7.5.1 Энергияның еркіндік дәрежелер бойынша бірқалыпты таралу заңы
- •7.5.2 Сыртқы күш өрісіндегі бөлшектер үшін Больцман таралуы
- •7.5.3 Газ молекулаларының жылдамдықтар бойынша таралу заңы (Максвелл заңы)
- •7.6 Термодинамикалық тепе-теңдіксіз жүйелердегі тасымалдау құбылыстары
- •7.6.1 Диффузия
- •7.6.2 Ішкі кедергі
- •Термодинамикның бірінші бастамасы
- •8.1 Жүйенің ішкі энергиясы
- •8.2 Жұмыс және жылу
- •8 Термодинамиканың бірінші заңы
- •8.4 Термодинамикалық процестер мен жұмыстың графиктері
- •8.5 Заттың жылусыйымдылығы
- •8.6 Термодинамиканың бірінші бастамасын идеал газдардағы изопроцестерге қолдану
- •8.6.1 Изохоралық процесс ( )
- •8.6.2 Изобаралық процесс ( )
- •8.6.3 Изотермиялық процесс ( )
- •8.6.4 Адиабаталық процесс ( )
- •8.6.5 Политроптық процесс ( )
- •Термодинамиканың екінші бастамасы
- •9.1 Қайтымды және қайтымсыз процестер
- •9.2 Дөңгелек процестер
- •9.3 Карноның идеал жылулық машинасы
- •9.4 Карно теоремасы
- •9.5 Клаузиус теңсіздігі
- •9.6 Энтропия
- •9.6.1 Энтропияның қасиеттері
- •9.7 Термодинамиканың екінші бастамасы
- •Нақты газдар мен булар
- •10.1 Молекула көлемін ескеру
- •10.2 Молекулалардың тартылыс күшін ескеру
- •10.4 Заттың критикалық күйі. Фазалық ауысулар
- •– Газдың универсал тұрақтысы. Сонымен, Ван-дер-Ваальс теңдеуі газ күйін, газдың сұйықтыққа айналу процесін және сұйықтықтың сығылуын сипаттай алады.
- •10.5 Нақты газдың ішкі энергиясы
- •III бөлім. Электр өрісі
- •Кулон заңы
- •Электрстатикалық өріс кернеулігі
- •Гаусс теоремасы
- •Электрстатикалық өрістердің қасиеттері
- •Электр өрісіндегі өткізгіштер
- •Электрлік сыйымдылық. Оқшауланған өткізгіштің электрлік сыйымдылығы
- •Өзара сыйымдылық. Конденсаторлар.
- •Электрстатикалық өрістегі диэлектриктер. Диэлектриктердің түрлері.
- •Диэлектриктердің поляризациясы. Поляризациялану.
- •Поляризациялық зарядтар
- •Электрлік ығысу векторы
- •Электр зарядтарының энергиясы
- •Зарядталған конденсатордың энергиясы
- •Өзара әсерлесуші зарядтардың энергиясы
- •Зарядталған өткізгіштің энергиясы
- •Ток күші және ток тығыздығы
- •Тармақталған тізбектерге арналған Кирхгоф ережелері
- •Газдардың электрөткізгіштігі
10.4 Заттың критикалық күйі. Фазалық ауысулар
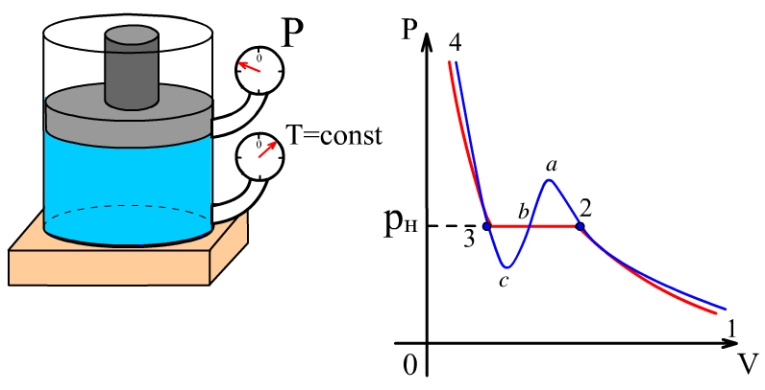
Ван-дер-Ваальстың теориялық изотермаларының физикалық мәнін олардың эксперименттік изотермаларымен салыстыра талдау арқылы түсінуге болады. 10.2–суретте қызыл сызықпен эксперименттік және көк сызықпен теориялық изотермалар берілген.
10.2-сурет. Фазалық ауысулар |
1-2
және 3-4 аралықтарда екі қисық бірігіп
кетеді. Ал 2-3 аралықта олардың
айырмашылықтары байқалады. Эксперимент
нәтижелері бойынша бұл аралықта көлем
кішірейгенімен қысым өзгермейді.
Бірақ, бұл уақытта газы толтырылған
ыдыстың қабырғасында сұйықтық
конденсирлене бастайды.
3 нүктеде
газ сұйықтыққа айнала бастайды.
Изотермияның
|
сәйкес
келетін жағдайда зат газ және сұйықтық
болатын екі агрегаттық күйде болады.
Бұл жағдайдағы газды қаныққан
бу,
ал оның қысымын қанығу
қысымы
деп атайды. Егер
осы күйде көлем тұрақты болса,
онда булану мен конденсация процестері
тепе-теңдікте
болады.
Изотерманың
3-4
аралығы
сұйықтыққа
сәйкес келеді. Сұйықтықтың
көлемі аз шамаға өзгерсе, қысым өте
үлкен шамаға өзгереді. Сондықтан, оларды
сығылмайтын орта ретінде қарастыруға
болады. Жүйені теориялық изотермаларының
![]() және
және
![]() аралықтарына сәйкес күйге келтіру үшін
арнайы жағдай орнату керек. Бірақ, бұл
күйлер орнықты
емес (метастабильді).
аралығында бу қысымы сол температурадағы
қаныққан бу қысымынан артық болады. Бұл
күйдегі буды аса
қаныққан бу
деп атайды.
аралығында сұйықтықтың қысымы сол
температурадағы қаныққан бу қысымынан
төмен болады. Мұндай сұйықтық аса
қызған сұйықтық
деп аталады.
аралықтарына сәйкес күйге келтіру үшін
арнайы жағдай орнату керек. Бірақ, бұл
күйлер орнықты
емес (метастабильді).
аралығында бу қысымы сол температурадағы
қаныққан бу қысымынан артық болады. Бұл
күйдегі буды аса
қаныққан бу
деп атайды.
аралығында сұйықтықтың қысымы сол
температурадағы қаныққан бу қысымынан
төмен болады. Мұндай сұйықтық аса
қызған сұйықтық
деп аталады.
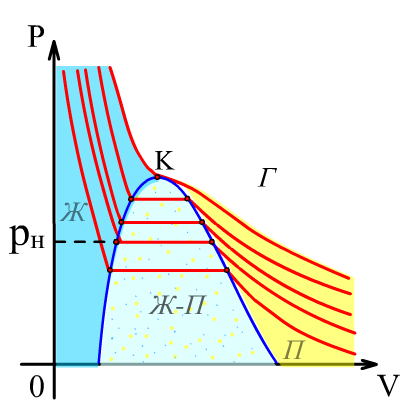
Егер
әртүрлі температурадағы эксперименттік
изотермалар сериясының горизонталь
бөліктеріндегі шеткі нүктелерді жалғаса,
онда қоңырау тәрізді қисық шығады (10.3
– сурет). Осы қисық пен К
бүгіліс нүктесінің сол жағындағы
изотермалар (![]() )
диаграмманы үш аймаққа бөледі: екіфазалық
күй аймағына (қоңырау тәрізді қисықтың
асты), сұйық күйге (сол жағы) және бу
аймағына (оң жағы).
)
диаграмманы үш аймаққа бөледі: екіфазалық
күй аймағына (қоңырау тәрізді қисықтың
асты), сұйық күйге (сол жағы) және бу
аймағына (оң жағы).
10.3 –сурет. Ван-дер-Ваальс изотермаларының сериясы |
Критикалық
изотерманың үстіндегі аймақтағы газға
қандай қысым берсе де, ол сұйыққа
айнала алмайды. К
нүктесіне сәйкес келетін
сұйықтықтың сығылуын сипаттай алады. Критикалық күй параметрлеры келесі өрнектермен анықталады:
Мұндағы: а мен b – Ван-дер-Ваальс түзетулері, |
– Газдың универсал тұрақтысы. Сонымен, Ван-дер-Ваальс теңдеуі газ күйін, газдың сұйықтыққа айналу процесін және сұйықтықтың сығылуын сипаттай алады.
10.5 Нақты газдың ішкі энергиясы
Идеал газдың ішкі энергиясы толығымен оның температурасына ғана тәуелді және молекулалардың жылулық қозғалысының кинетикалық энергиясымен анықталады:
![]()
![]() ,
(10.6)
,
(10.6)
мұндағы
![]() –
газдың тұрақты көлемдегі мольдік
жылусыйымдылығы,
–
газдың тұрақты көлемдегі мольдік
жылусыйымдылығы,
![]() – газ молекуласының еркіндік дәрежесі.
Нақты
газдардың ішкі энергиясын
есептегенде, молекулааралық күштерді
тудыратын
– газ молекуласының еркіндік дәрежесі.
Нақты
газдардың ішкі энергиясын
есептегенде, молекулааралық күштерді
тудыратын
потенциалдық энергияны ескеру керек. Сондықтан, ішкі энергия кинетикалық және потенциалдық энергиялардың қосындасына тең:
![]() .
(10.7)
.
(10.7)
Молекулааралық ілінісу күштері қосымша ішкі қысым тудырады (10.2):
.
Ол күштердің жұмысы потенциалдық энергияның өзгерісіне тең болады:
![]()
Соңғы өрнектен интеграл алса:
![]() .
.
Газ көлемі шексіз өскенде молекулалардың ара қашықтығы да өседі, потенциалдық энергия нөлге айналады. Осы шартты ескеріп, интегралдау тұрақтысын нөлге теңестіреміз (С=0). Нақты газдың ішкі энергиясы оның кинетикалық және потенциалдық энергиялардың қосындысына тең. Сондықтан ол Т температураға және V көлемге тәуелді болады:
![]() .
(10.8)
.
(10.8)
Термодинамиканың
бірінші заңы (![]() )
бойынша: газ вакуумда адиабаттық ұлғайса
(
)
бойынша: газ вакуумда адиабаттық ұлғайса
(![]() ),
онда жұмыс жасалмайды (
),
онда жұмыс жасалмайды (![]() ),
олай болса, оның ішкі энергиясы өзгермейді
(
),
олай болса, оның ішкі энергиясы өзгермейді
(![]() және
және
![]() ).
).
Бұл теңдік идеал газ үшін де, нақты газ үшін де орындалады. Бірақ осы екі жағдай үшін олардың физикалық мағыналары әртүрлі.
Идеал
газ үшін
![]() теңдігі олардың температураларының
тең болатынын (
теңдігі олардың температураларының
тең болатынын (![]() )
білдіреді, яғни, идеал
газ вакуумда адиабаталық ұлғайғанда,
оның температурасы өзгермейді.
)
білдіреді, яғни, идеал
газ вакуумда адиабаталық ұлғайғанда,
оның температурасы өзгермейді.
Нақты
газдың ішкі энергиясы
,
бірақ (10.8) теңдеуден, нақты газ вакуумда
адиабаталық ұлғайғанда оның
![]() көлемі де,
көлемі де,
![]() температурасы да өзгереді. Көлем мен
температураның өзгеру таңбалары
қарама-қарсы. Олай болса, нақты
газ көлемі вакуумда ұлғайған кезде, ол
салқындайды, сығылған кезде – қызады.
температурасы да өзгереді. Көлем мен
температураның өзгеру таңбалары
қарама-қарсы. Олай болса, нақты
газ көлемі вакуумда ұлғайған кезде, ол
салқындайды, сығылған кезде – қызады.
Әдебиеттер:
Негізгі: 1 [317-335], 2 [141-152], 3 [165-181].
Қосымша: 12 [103-110].
Бақылау сұрақтары:
1. Ван-дер-Ваальс теңдеуінде идеал газды қарастырғанда ескерілмеген қандай шамалар ескеріледі?
2. Нақты газдың ішкі энергиясы қандай күй параметрлеріне тәуелді?
3. Сұйық су, оның буы және мұздың екі түрлі кристалдық модификциясы бір-бірімен тепе-теңдікте бола ала ма?
11-дәріс