
IX. Микробиологическая диагностика туберкулеза
Бактериологическое исследование у лиц с заболеваниями органов дыхания начинается, как правило, в учреждениях общей лечебной сети в клинико-диагностических лабораториях. При обнаружении бактериоскопическим методом кислотоустойчивых микобактерии (более 3 в 100 полях зрения) больной направляется в противотуберкулезный диспансер. В бактериологических лабораториях противотуберкулезных диспансеров проводится комплекс микробиологических методов исследования. Помимо бактериоскопии мазка выполняются все этапы культу рал ьного исследования с целью получения роста возбудителя и его идентификации с последующим определением чувствительности выделенной культуры к противотуберкулезным препаратам. Микробиологической диагностике может подлежать любой биологический и патологический материал, выделенный от больного: мокрота, промывные воды желудка и бронхов, смыв из бронхиального дерева, материал, полученный при бронхо-альвеолярном лаваже, моча, капиллярная и венозная кровь, плевральный и перикардиальный выпот, спинномозговая жидкость; отделяемое из свищей, биоптаты, приготовленные из операционного материала или полученные при щеточной и щипцевой биопсии. У больных, выделяющих мокроту, собирают ее утреннюю порцию. Правильно собранная мокрота имеет слизистый или слизисто-гнойный характер. Оптимальный объем исследуемой порции мокроты составляет 3-5 мл. Необходимо иметь в виду, что в момент откашливания больным мокроты создается очень высокий риск воздушно-капельного распространения инфекции. В связи с этим необходимо, чтобы сбор мокроты проводили в специальном, хорошо вентилируемом помещении, оснащенном бактерицидными, ультрафиолетовыми лампами и средствами дезинфекции. Сбор мокроты проводится под контролем медицинского работника.
Правила сбора мокроты:
- перед сбором мокроты больной должен хорошо прополоскать
рот водой, чтобы механически удалить основную часть посторонней микробной флоры и остатки пищи, загрязняющие мок роту;
прикрыть рот и нос куском ткани или носовым платком и откашлять мокроту из глубины грудной клетки. Если больной не может откашлять спонтанно мокроту, необходимо сделать несколько глубоких вдохов и затем задержать дыхание. Несколько аналогичных повторов чаще всего способствуют возникновению кашля;
поднести контейнер к нижней губе и осторожно высвободить мокроту из полости рта в контейнер, избегая брызг и расплескивания. Затем плотно закрыть контейнер крышкой;
поместить контейнер в штатив.
При исследовании мокроты желательно собрать не менее 3 проб утренней мокроты в течение 3 дней, что повышает результаты исследования. Если больной не выделяет мокроту, то накануне или рано утром ему следует дать отхаркивающие и муколитические средства или применить раздражающие ингаляции.
Собранный материал необходимо как можно быстрее отправить в лабораторию. При невозможности немедленной доставки материал сохраняется в холодильнике при температуре +4°С не более 48 часов.
Промывные воды бронхов. Сбор материала производится врачом-отоларингологом. Больному несколько раз во время вдоха вводят шприцем в трахею 5-7 мл подогретого стерильного изстоническо-го раствора, который вызывает кашлевой рефлекс. При этом откашливается секрет из глубоких отделов бронхиального дерева. Промывные воды бронхов собирают в стерильный флакон и направляют в бактериологическую лабораторию.
У детей младшего возраста, которые плохо откашливают мокроту и часто заглатывают ее, могут быть исследованы промывные воды желудка. Промывные воды желудка следует брать натощак, перед забором материала больному дают выпить 100,0-150,0 раствора питьевой соды. После этого вводят желудочный зонд и собирают содержимое желудка в стерильный флакон.
Исследование мочи. Моча (средняя утренняя порция) собирается в стерильную посуду после туалета половых органов. Анализ мочи на возбудитель туберкулеза должен проводиться трижды,
Бактсриоскопические методы исследования патологического материала. Сущность метода заключается в способности микобактерий, окрашенных карболовым фуксином, удерживать краситель после длительного обесцвечивания в соляно-кислом спирте.
Методика окраски мазка методом Циля-Нельсена:
готовят тонкий мазок на предметном стекле, который высушивают при комнатной температуре и фиксируют над пламенем горелки с использованием бесцветного или голубого пламени, располагая стекло мазком вверх;
на фиксированный препарат накладывают полоску фильтровальной бумаги размером немного меньше предметного стекла, но так, чтобы она закрыла мазок полностью. Фильтровальную бумагу используют для того, чтобы краска не разливалась по стеклу;
наливают на бумагу приблизительно 5 капель раствора карболового фуксина (фенола по Цилю-Нельсену) и нагревают препарат над пламенем горелки до появления паров, не допуская закипания краски и подсыхания бумага;
подогретый мазок оставляют на 5 минут;
после удаления фильтровальной бумаги при помощи пинцета препарат промывают проточной водой или водой из резервуара;
мазок обесцвечивают в 25% растворе серной кислоты (Н2304) или в 3% соляно-кислом спирте, наливая на него несколько капель до полного обесцвечивания. Продолжительность процедуры обесцвечивания - 2-3 минут;
повторно мазок промывают проточной водой;
мазок докрашивают 0,3 % раствором метиленового синего стечение 60 секунд;
мазок промывают проточной водой;
мазок высушивают при комнатной температуре в вертикальном положении.
В результате выполненной процедуры кислотоустойчивые микобактерий окрашиваются в малиново-красный цвет, а другие микроорганизмы и клеточные элементы - в голубой. Препарат микроскопируют с масляной иммерсией в световом бинокулярном микроскопе, просматривают не менее 100 полей зрения. Чувствительность микроскопии при окраске мазков по методу Циля-Нельсена составляет 50.000-100.000 бактериальных клеток в 1 мл материала. У больных с остро прогрессирующими формами туберкулеза кислотоустойчивые бактерии можно выявить при их содержании свыше 5.000 микробных тел в 1 мл мокроты (табл. 4).
Таблица 4
Учет результатов микроскопического исследований патологического материала при окраскепо методу Циля-Нельсена
|
Количество кислотоустойчивых микобактерий |
Число иммерсионных полей зрения |
Ответ |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
качественный |
количественный |
||||||
|
Отсутствуют 300 |
отрицательны и 0 |
||||||||
|
|
|
|
|
||||||
|
|
|
||||||||
|
|
|
||||||||
|
|
|
||||||||
|
|
|
||||||||
1-3 |
300 |
сомнительный |
Рекомендовано повторить исследование |
1-9 |
100 |
положительный |
единичные в препарате, указать число МВТ |
10-99 |
100 положительный единичные в поле зрения (1+) |
||
1-10 |
1 положительный умеренное количество (2+) |
||
Более 10 |
1 |
положительный |
значительное количество (3+) |
Микроскопическое обнаружение кислотоустойчивых микобактерий (КУМ) не позволяет дифференцировать m.tuberculosis от нетуберкулезных микобактерий - возбудителей микобактериозов, а следовательно, не позволяет достоверно определить этиологию заболевания.
Морфологическая характеристика
кислотоустойчивых микобактерий при окраске
по методу Циля-Нельсена
- кислотоустойчивые микобактерий туберкулеза имеют длину 1,0-10,0 мкм, они просматриваются в
виде тонких, изящных палочек, но иногда можно обнаружить изогнутые или извитые особи.
Палочковидные формы могут располагаться в виде небольших скоплений, напоминающих «птичью лапку»,
отдельных клеток или в виде кос, жгутов. Напоминаем, что микобактерий туберкулеза синтезируют
корд-фактор, способствующий косообразованию колоний (рис. 4); " при окраске карболовым фуксином кислотоустойчивые микобактерий выявляются в виде тонких, слегка
изогнутых палочек малиново-красного цвета, содержащих различное количество гранул (зерен);
микроорганизмы располагаются по одиночке, парами или в виде групп, выделяющихся на голубом фоне; "внутри отдельных микробных клеток могут обнаруживаться участки более интенсивного окрашивания, в
результате чего они похожи на «бусы», а более слабо окрашенные участки могут быть видны в виде
«полос»; • другие микроорганизмы, не относящиеся к m.tuberculosis, могут иметь различные формы - от длинных
палочек до кокковых форм с различной интенсивностью окрашивания.
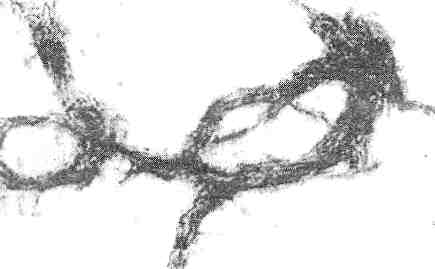
Рис. 4. Рост микроколоний М. 1иЬегси1оз!5 в виде жгутов и кос. Окраска по методу Циля-Нельсена, У в. 900 Люминесцентная микроскопия. Метод обладает более высокой чувствительностью в обнаружении микобактерий. Сущность люминесцентной микроскопии заключается в том, что клетки, окрашенные специальными красителями (флюорохромами), дают излучение в видимом спектре под действием облучения их ультрафиолетом Если тетки содержат специальный краситель, то молекулы под действием ультрафиолета начинают испускать кванты света в длинноволновой области, иначе говоря, «светятся». В этом случае клетка становится источником света определенного спектра и оказывается хорошо видимой на общем темном контрастном фоне препарата.
Способность МВТ воспринимать люминесцентные красители обеспечивает большую контрастность микроскопической картины и позволяет обнаружить КУМ при концентрациях 500-1.000 микробных тел в 1 мл материала.
Люминесцентная микроскопия позволяет дополнительно выявить МВТ на 17% больше по сравнению со световой микроскопией. Она незначительно уступает по чувствительности методу посева.
Другим важным преимуществом этого метода является способность обнаруживать измененные МВТ, утратившие под влиянием ряда неблагоприятных факторов (интенсивной химиотерапии) свойство кислотоустойчивое™ и не выявляющиеся в связи с этим при окраске по методу Циля-Нельсена.
При люминесцентной микроскопии используют специальный микроскоп. Источником света служит кварцгалогеновая или ртутная лампа.
Метод окраски аурамином и родамином (модифицированная окраска по Бою):
на стекла с фиксированными мазками наливают раствор 1 (аура-мин ОО 1,0+родамин С 0,12+дистиллированная вода 1.000 мл) на 1 час;
тщательно/промывают дистиллированной водой;
обесцвечивают соляно-кислым спиртом в течение 3-5 мин.;
промывают дистиллированной водой;
гашение фона осуществляют раствором 4 (хлорид метиленового синего 0,3 г + дистиллированная вода 1.000 мл) в течение 60 секунд;
мазки высушивают при комнатной температуре.
Бактерии, окрашенные ауромином и родамином, будут давать желтое, желто-оранжевое свечение.
Более чем столетний опыт фтизиатров всего мира показывает, что классическое сочетание культурального и микроскопических методов исследования по-прежнему остается высокоинформативным, несмотря на появление большого числа альтернативных методов.
Культуральный метод отличается большей чувствительностью, он позволяет выявить МВТ при наличии в исследуемом патологическом материале нескольких десятков жизнеспособных особей возбудителя (иногда всего лишь не более 10). Достоверно подтвердить туберкулезную природу заболевания, изучить биологические свойства выявленного возбудителя и выявить его лекарственную чувствительность возможно только при выделении семейства микобактерий культуральными методами исследования.
Для получения оптимальных результатов при изучении клинического материала необходимо соблюдать следующие условия:
сбор клинического материала необходимо проводить до начала химиотерапии, так как даже несколько дней специфического лечения могут убить или уменьшить жизнеспособность значительного количества кислотоустойчивых бактерий и снизить результативность исследования;
на фоне лечения противотуберкулезные препараты отменяются не менее чем за двое суток до сбора материала;
материал для исследования должен собираться до утреннего приема лекарственных препаратов;
при исследовании мокроты желательно собрать не менее трех проб утренней мокроты в течение 3 последующих один за другим дней;
собранный материал необходимо как можно быстрее доставить в лабораторию; в случае невозможности доставки материал сохраняется в холодильнике при температуре +5-10°С;
при перевозке материала необходимо тщательно следить за сохранностью флаконов.
Сущность метода заключается в получении культуральной массы МБТ путем засева обработанного детергентами диагностического материала на питательные среды, предназначенные для роста МБТ. Среди питательных сред выделяют три группы:
• плотные питательные среды на яичной основе;
«плотные или полужидкие питательные среды на агаровой основе;
• жидкие синтетические или полусинтетические питательные среды.
Общепринятой стандартной средой для выращивания МБТ является плотная яичная питательная среда Левенштейна-Йенсена, которая состоит из яичной массы, приготовленной из свежих диетических яиц, вымытых проточной водой щеткой и мылом. Вымытые яйца погружают на 30 минут в 70% спирт. Кроме того, в среду входят следующие ингредиенты (солевой буфер): однозамещенный фосфорнокислый натрий, магний сернокислый, 1-аспарагин, глицерин, магний лимоннокислый. Для повышения эффективности роста возбудителя туберкулеза используется одновременно и вторая среда: Финна II. Эта среда отличается от предыдущей тем, что вместо 1-аспарагина в ней используется глутамат натрия и подбор солей рассчитан таким образом, что конечная кислотность среды (РН=6,3-6,5) имеет более низкое значение и большую стабильность. Эти свойства обусловливают более высокую эффективность среды при засеве материала, обработанного щелочными детергентами.
Для создания фона в среды вводится малахитовая зелень. Посевы помещают в термостат при температуре +37°С, так как оптимальный рост колоний т.1иЬегси1оз15 происходит при нормальной температуре организма человека. Посевы просматривают каждые 7-10 дней. Рост возбудителя появляется на 3-6 неделе, чаще в виде сухих шероховатых К-колоний. Положительный ответ лаборатория выдает только после микроскопии выросших колоний.
Культуральные исследования проводят как до начала лечения, так и в процессе него. В результате химиотерапии количество возбудителя может уменьшиться, появляются колонии с гладким влажным ростом, в диагностическом материале таких больных могут появиться 1-формы и кокковые формы МВТ.
При оценке результатов руководствуются следующими критериями:
появление роста - срок появления, начиная со дня посева;
интенсивность роста - число колоний;
загрязнение посева посторонней микрофлорой или грибами;
отсутствие роста.
На основании лучения сроков появления роста и его особенностей осуществляется первичная идентификация микобактерий;
• появление роста кислотоустойчивых микобактерий в течение 7-10 дней культивирования на плотных питательных средах свидетельствует о выделении быстрорастущих нетуберкулезных МВТ, к которым комплекс т.tuberculosis не относится;
• появление роста кислотоустойчивых микобактерий после 3-4 недель культивирования свидетельствует о выделении, т. tuberculosis а также других медленно растущих микобактерий, которые мо гут относиться к потенциально патогенным нетуберкулезным МВТ или к безвредным кислотоустойчивым сапрофитам;
• прежде чем дать отрицательный ответ после 2,5-3 месяцев культивирования, необходимо убедиться в отсутствии роста очень медленно растущих МВТ, в числе которых могут быть и г.tuberculosis.
Характеристика колоний г.tuberculosis. . Обычно вирулентные культуры микобактерий туберкулеза растут на плотных питательных средах в виде К-колоний различной величины и вида, имеют желтоватый (но не желтый) или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую крошки хлеба или цветную капусту. Колонии, как правило, сухие, морщинистые, но могут встречаться и влажные, слегка пигментированные колонии, розовато-желтый пигмент которых резко отличается от оранжевого или желтого пигмента сапрофитных или некоторых нетуберкулезных микобактерий. Последние обычно растут в виде 3-формы. Следует отметить, что на среде Финна колонии часто выглядят более влажными, чем на среде Левенштейна-Йенсена,
Ответ при культуральном исследовании на микобактерий туберкулеза дается только после микроскопии окрашенного по методу Циля-Нельсена мазка из выросших колоний.
Интенсивность роста обозначается по трехбалльной системе: (+) 1-20 колоний в пробирке - «скудное» бактериовыделение; (++) 21-100 колоний в пробирке - «умеренное» бактериовыделение; (+++) > 100 колоний в пробирке - «обильное» бактериовыделение.
Дифференциация r.tubercu/osis.. Одного какого-либо лабораторного метода, позволяющего отличить T.tuberculosis.oi других кислотоустойчивых микобактерий, не существует. Для дифференциации т.tuberculosis., /77. Bovis, /77. Africanum, m. microti от других кислотоустойчивых микобактерий используются следующие основные биохимические тесты:
на наличие способности продуцировать никотиновую кислоту -•ниациновый тест;
на наличие редуктазы;
• на наличие способности расти на среде с натрием салицилово-кислым (1 мг/мл); Mycobacterium tubercu/osisSхарактеризует следующая совокупность признаков:
медленная скорость роста; •температура роста - +35-37°С;
отсутствие пигментообразования,
положительный ниациновый тест;
отсутствие термостабильной каталазы (68°С);
• отсутствие роста на среде Левенштейна-Йенсена, содержащей паранитробензойную кислоту (500 мгк/мл), хлорид натрия (5%), изониазид (10 мкг/мл для лекарственно чувствительных r.tubercu/osis..
Радиометрический метод выявления микобактерий туберкулеза. В 1977 г. A.Middlebrook описал способ радиометрической детекции роста микобактерий в селективной жидкой среде, что положило начало выявлению возбудителя туберкулеза новым способом бактериологической диагностики.
С начала 80-х годов стала использоваться полуавтоматическая система ВАСТЕС-460 для выращивания и идентификации микобактерий с использованием жидкой среды A.Middlebrook 7 Н9.В данной системе рост возбудителя определяется путем регистрации уровня меченого С02, который образуется в процессе утилизации размножающимися микроорганизмами субстрата с пальмитиновой кислотой, содержащей радиоактивный углерод (С14). Применение этого .метода позволяет сократить сроки получения результатов выявления микобактерий до 5-6 дней. В настоящее время с целью регистрации роста возбудителя туберкулеза и определения его чувствительности к противотуберкулезным препаратам используется автоматизированная система ВАСТЕС №ЗЛГ 960. Данная система позволила проводить быструю идентификацию т.tuberculosis сотр/ех и определять лекарственную чувствительность возбудителя туберкулеза.
Для практических лабораторий оптимальные результаты культу-рального выявления микобактерий могут быть получены при использовании диагностический системы в комбинации с плотными средами (Левенштейна-Йенсена, Финн-Н).
Биологический метод диагностики микобактерий туберкулеза. Указанный метод применяется в лабораториях научно-исследовательских институтов, отличается высокой чувствительностью и превосходит культуральный. При наличии 1-10 живых микробных тел в 1 мл диагностического материала возможно развитие туберкулеза у животного. Наиболее чувствительными к r.tuberculosis являются морские свинки, к r.bovis кролики, белые мыши. Однако с введением в клиническую практику химиотерапии и появлением форм возбудителя, устойчивых к лекарственным препаратам, биологическая проба утратила свою эффективность, так как часто микроорганизмы, устойчивые к химиотерапевтическим препаратам, в частности к изониазиду, являются авирулетными для морских свинок.
Для повышения частоты обнаружения в патологическом материале возбудителя туберкулеза помимо подкожного способа заражения можно использовать интратеетикулярный. При таком методе заражения удается чаще обнаруживать в патологическом материале изониа-зидоустойчивые слабовирулетные микобактерий.
Заражение морских свинок следует проводить в диагностических случаях для подтверждения туберкулезной этиологии заболевания как впервые выявленных, так и уже получавших противотуберкулезную терапию.
Особую ценность биологическая проба имеет у больных, страдающих урогенитальным туберкулезом.
Обработка материала для заражения морских свинок. Для заражения морских свинок используют различный материал: мокроту, мочу, промывные воды бронхов, желудка, экссудаты, отделяемое из ран, операционный материал.
Исследуемый материал обрабатывают, как и для посева, 3-4% серной кислотой (Н2504).
После обработки кислотой его дважды отмывают стерильным физиологическим раствором, чтобы не осталось кислоты, так как при ее попадании животному под кожу может возникнуть язва.
К полученному осадку добавляют 1 мл стерильного физиологического раствора и вводят морской свинке под кожу правой паховой области или в область яичка.
За животным проводят наблюдение, проверяя появление местного инфильтрата, состояние регионарных лимфатических узлов и общее состояние.
Через 1,5-3 месяца проверяют чувствительность к туберкулину, вводя внутривенно в среднюю часть брюшка 0,1 мл туберкулина {100 ТЕ РРО-1). Реакцию учитывают через 48 и 72 часа. Положительной считают реакцию при появлении инфильтрата более 5 мм. Он бывает у свинок, инфицированных возбудителем туберкулеза.
При наличии в патологическом материале достаточного количества вирулентных микобактерий уже через 2 недели на месте заражения может появиться инфильтрат или язва. Регионарные лимфатические узлы увеличиваются через 1 месяц.
Забивают подопытных животных через 1,5 или 3 месяца. Если заражены два животных одним и тем же патологическим материалом, то одно животное забивают через 1,5, а другое - через 3 месяца. При забое морских свинок через 1,5 месяца в месте введения патологического материала отмечают инфильтрат, нередко с распадом, увеличение регионарных лимфатических узлов, единичные туберкулезные очаги в легких, иногда - в селезенке.
При забое морских свинок через 3 месяца отмечается увеличение лимфатических узлов, как регионарных, так и отдаленных, появление очагов в легких, печени, селезенке.
Степень поражения внутренних органов зависит от количества и вирулентности МВТ, содержащихся в патологическом материале.
Иногда при обследовании олигобациллярных больных МВТ из патологического материала методом посева не выделяются, к при заражении подопытного животного могут определяться незначительные изменения в регионарных лимфатических узлах или в органах. В таких случаях рекомендовано делать посев из органов подопытного животного для получения культуры и ее дальнейшего изучения.
Молекулярно-генетические методы. К прямым методам обнаружения МВТ можно отнести молекулярно-генетические исследования, такие как способ полимеразной цепной реакции, в основе которого лежит многократное увеличение числа копий специфического участка ДНК (направленная или избирательная амплификация ДНК). Главным достоинством этого метода является высокий уровень чувствительности (в диапазоне от 1 до 10 клеток в исследуеом материале), достигаемый за счет того, что в результате многократного копирования уровень специфическойм олигонуклеотидной последовательности возрастает в 106-10 раз (положительные результаты анализа достигают 70-96%). Метод эффективен в отношении возбудителя туберкулеза, учитывая его высокую антигенную изменчивость (трансформация в 1-формы, персистирующие микроорганизмы и др.). С помощью этого метода можно выполнить идентификацию штамма возбудителя туберкулеза. Недостатком его является невозможность определения жизнеспособности выделенных микобактерии, а также риск возникновения ложноположительных и ложноотрицательных результатов.
Косвенные методы определения наличия возбудителя туберкулеза в организме больного основаны на выявлении специфических антител к антигену в различных биологических субстратах. С этой целью используется метод иммуноферментного анализа (ИФА). Метод ИФА прост в исполнении, хорошо воспроизводим, требует небольшого количества патологического материала. С его помощью антигены и антитела можно выявлять в различном биологическом материале, полученном от больного,
Принцип метода состоит в том, что антитела в патологическом материале связываются со специфическим антигеном, адсорбированном на пластике. При этом образуется комплекс антиген-антитело.
Микробиологические методы определения лекарственной устойчивости. В настоящее время для определения лекарственной устойчивости к противотуберкулезным препаратам в нашей стране используются следующие основные методы:
метод абсолютных концентраций;
ускоренный метод Грисса;
автоматизированная система ВАСТЕС-ТВ;
молекулярно-генетический метод.
Метод абсолютных концентраций. Данный метод исследования выполняется на яичной среде Левенштейна-Йенсена, позволяет определять лекарственную устойчивость МБТ в диагностическом материале, содержащем любое количество колоний, поскольку для ее определения используются штаммы, предварительно выращенные на плотных питательных средах.
Поскольку сроки выделения возбудителя на питательных средах составляют не менее 1-1,5 месяцев, результаты определения лекарственной устойчивости указанным методом поступают не ранее, чем через 2-2,5 месяца после забора материала. Методы определения лекарственной устойчивости после выделения культуры МБТ получили название непрямых.
Критерии лекарственной устойчивости. Уровень устойчивости данного штамма выражается той максимальной концентрацией препарата (количество микрограмм в 1 мл питательной среды), при которой еще наблюдается размножение микобактерии (по числу колоний на плотных средах).
Лекарственно устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное действие. Для различных препаратов установлена определенная концентрация (критическая), имеющая клиническое значение, при которой еще наблюдается размножение чувствительных к этому препарату микобактерии.
Границей или критерием устойчивости называют те наиболее низкие концентрации препарата в питательной среде, выраженные в микрограммах на 1 мл, при которых размножаются устойчивые особи. Определение лекарственной устойчивости МБТ необходимо проводить на плотной питательной среде Левенштейна-Йенсена, При определении лекарственной устойчивости МБТ на плотных средах культура считается чувствительной к той концентрации препарата, которая содержится в среде, если число колоний, выросших на одной пробирке с препаратом, не превышает 20. При наличии более 20 колоний культура расценивается как устойчивая. Концентрации противотуберкулезных препаратов, используемых при определении лекарственной устойчивости МБТ, представлены в таблице 5.
Таблица 5
Критические концентрации противотуберкулезных препаратов
при оценке лекарственной устойчивости МБТ методом абсолютных концентраций на среде Левенштейна-Йенсена
|
Наименование препарата |
Концентрация мгк/мл |
||||||
|---|---|---|---|---|---|---|---|---|
|
Стрептомицин |
10 |
2550 |
|||||
|
Изониазид |
1 |
1025 |
|||||
|
|
|
|
|||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
|
|
|
||||||
Рифампицин |
40 |
50 |
Этамбутол |
2 |
5 |
Биомицин |
30 |
50 |
Канамицин |
30 |
50 |
Протионамид (этионамид) |
30 |
50 |
Циклосерин |
30 |
50 |
ПАСК |
1 |
5 |
Офлоксацин |
10 |
|
Амикацин |
8 |
|
|
|
|
Ускоренный метод Грисса является модифицированным в ЦНИИТ РАМН (Голышевская В,И., 2002) методом абсолютных концентраций, который позволяет получить адекватный результат резис-тентности выделенных штаммов МВТ на 7-10-й день. Для ускоренного метода определения лекарственной устойчивости МВТ используют определение нитроредуктазной активности с помощью реактива Грисса. Метод пригоден для определения только МВТ человеческого вида {mycobacterium tuberculosis tupus humanus), имеющих в своем соста-ие нитроредуктазу. При наличии в пробирке возбудителя туберкулеза и при добавлении реактива Грисса происходит изменение окраски от малиновой до бурой. При отсутствии МВТ среда цвет не меняет.
Определение лекарственной устойчивости микобактерий туберкулеза на автоматизированной системе ВАСТЕС-460 ТВ и ВАСТЕС МСЗ 960. Кроме классических методов культивирования МВТ на плотных питательных средах в настоящее время в России сертифицированы и нашли свое применение следующие системы культуральной диагностики МВТ и определения лекарственной устойчивости.
ВАСТЕС-460 ТВ и ВАСТЕС МЗЛТ 960 представляют автоматизированную радиометрическую систему для выявления МВТ в диагностическом материале и определения лекарственной устойчивости к основным противотуберкулезным препаратам.
Для роста МВТ в системе используются флаконы с жидкой питательной средой, которая представляет собой обогащенную middelerook 7Н9 бульонную основу, содержащую С 02 в пространстве над средой во флаконе. В процессе тестирования газ автоматически забирается из флакона, уровень радиоактивности измеряется и регистрируется в виде индекса роста на шкале от 0 до 999. Результат посева считается положительным, если обнаруживается высокий уровень С1402 во флаконах и замеренная радиоактивность превышает заданный порог Ежедневное увеличение индекса роста пропорционально степени роста МВТ в среде. Наличие микобактериального роста может быть зафиксировано, начиная с 4-5 суток с момента посева, учет результатов производят в течение 6 недель.
Молекулярно-генетический метод анализа. Метод является альтернативным вариантом решения проблемы определения лекарственной устойчивости, основанным на выявлении точечных мутаций или других генетических детерминант, обеспечивающих резистентность к лекарственным препаратам, применяемым в лечении туберкулеза. Время анализа для этих методов составляет 1-2 дня. Существует несколько методических подходов для выявления мутаций ДНК возбудителя туберкулеза.
Одним из новых подходов для решения проблемы быстрого выявления МВТ и определения резистентное к лекарственным препаратам являются биологические микрочипы.
Микрочип представляет собой матрицу, состоящую из ячеек полиакриламидного геля, нанесенных на стеклянную поверхность и содержащих олигонуклеотидные зонды. В силу высокой чувствительно сти биологические микрочипы могут быть использованы для одновременной идентификации возбудителя и определения лекарственной устойчивости к целому ряду лекарственных препаратов с определением типа мутации, ответственной за резистентность.
Было установлено, что тест-система на основе биологических микрочипов способна обнаруживать в образце количество ДНК, соответствующее единичным клеткам.
Контрольные вопросы:
1 . Охарактеризуйте правила сбора мокроты для микробиологического исследования на МВТ.
Опишите методику окраски мокроты по методу Циля-Нельсена.
Дайте характеристику учета результатов микроскопического исследования патологического материала при окраске по методу Циля-Нельсена.
Охарактеризуйте тактику врача при получении сомнительного ответа на наличие КУМ в мазке.
Какие достоинства имеет люминесцентная микроскопия перед световой микроскопией?
Укажите преимущества культу рал ьного метода исследования патологического материала на МВТ.
Укажите группы питательных сред, наиболее часто используемых для культивирования МВТ.
Охарактеризуйте колонии МВТ на плотных питательных средах (Левенштейна-Йенсена и Финн-Н).
Что включают в себя понятия: скудное, умеренное, обильное бактеррювыделение на плотных питательных средах?
Опишите основной принцип выявления МБТ радиометрическим методом?
Укажите основные достоинства и недостатки биологического метода диагностики МБТ.
Что является основой метода ПЦР для выявления МБТ?
Охарактеризуйте сущность метода «абсолютных концентраций» для определения лекарственной устойчивости МБТ впатологическом материале.
ЗАКЛЮЧЕНИЕ
Изучив представленное Вашему вниманию пособие, Вы еще раз смогли убедиться в уникальности возбудителя туберкулеза, этого повсеместно распространенного, тяжелого, лидирующего по уровню смертности среди всех инфекционных процессов заболевания. Особенности микобактерий туберкулеза (устойчивость, изменчивость, полиморфизм и другие) создают объективные трудности в диагностике и лечении вызываемой ими болезни.
Единственным доказательным методом верификации диагноза туберкулеза является обнаружение возбудителя в патологическом материале, поскольку ни клинических, ни лучевых, ни иных лабораторных патогномоничных признаков он не имеет. Несмотря на все технические достижения XX века (внедрение метода ПЦР, обратной транскрипции ПЦР с детекцией РНК и других), совершенного и доступного способа обнаружения МВТ пока не существует и «золотым стандартом» в практических учреждениях по-прежнему остается сочетание микроскопического и культурального исследований.
Микобактерий туберкулеза отличаются от других инфекционных патогенов, так как для большинства инфекций вирулентность есть степень патогенности, но для обсуждаемого возбудителя это не столь однозначно, поскольку не выявлена корреляция между вирулентностью и жизнеспособностью МВТ, между их вирулентностью и клинической картиной, длительностью болезни и результатами лечения (Б.И.Вишневский ссоавт.,2002).
Уникален и геном МВТ, так как он содержит гены, многократно дублирующие функционирование ключевых ферментных систем. На течении заболевания и его исходах отражается и неоднородность популяции МВТ в организме больного - присутствуют и лекарственно чувствительные и устойчивые штаммы в различной пропорции даже внутри одного пораженного органа, внеклеточно бурно размножающиеся особи и внутриклеточио персистирующие в макрофагах без потери патогенных свойств. Внутриклеточное существование возбудителя обусловливают такие особенности туберкулеза, как длительность и волнообразность течения, полиморфизм клиники и разнообразие локализаций, наклонность к рецидивам и относительность приобретенного иммунитета.ьВысокая степень гомогенности и инертности генома позволили предположить относительную эволюционную молодость возбудителя туберкулеза и связанную с этим его повышенную агрессивность при развитии заболевания (Пальцев М., 2003).
Особенности МВТ обусловливают сложности лечения заболевания, его не удовлетворяющую врачей эффективность особенно при развитии множественной лекарственной устойчивости. Решить эту проблему с помощью только одной химиотерапии невозможно, поскольку к любому новому препарату микроб рано или поздно выработает резистентность. В связи с этим формируется новый подход к лечению туберкулеза – генная терапия.
Таким образом, несмотря на то что с момента открытия возбудителя туберкулеза Р.Кохом минуло более 120 лет, микроб во многом остается загадочным и непредсказуемым и, следовательно, требуется его дальнейшее настойчивое изучение с помощью новейших технологий для создания более совершенных методов диагностики и лечения туберкулеза.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 . Борисов СЕ. Диагностика туберкулеза; возможности и пределы // Проблемы туберкулеза. - 2001. - С, 5-9.
Визель А.П. Лечение туберкулеза органов дыхания: Руководство для врачей. - Казань, 1998.
Вишневский Б.Н., Нарвская О.В. соавт. Вирулентность микобактерий туберкулеза// Проблемы туберкулеза. - 2002. .1 № 10. -С. 33-35.
Голышевская В.И. Бактериологические методы исследования при заболеваниях органов дыхания // Проблемы туберкулеза. - 1977. -№6.-С. 51-53.
Голышевская В.И. Организация микробиологически диагностики туберкулеза в России: Сб. к 75-летию ведущего противотуберкулезного учреждения г. Москвы. - М., 2001, с. 220-221.
Дорожкова И.Р. Формы персистирования микобактерий туберкулеза в организме человека: Дис... д-ра мед. наук. - М., 1972.
Дорожкова И.Р., Кочемасова З.Н., Дахно М.М. Выделение 1,.-форм микобактерий туберкулеза из патологического материала: Метод, рекомендации. - М., 1984.
Дорожкова И.Р., Земскова З.С. Скрыто протекающая туберкулезная инфекция. - М., 1984.
9. Драбкина Р.И. Микробиология туберкулеза. -М.: Медгиз, 1963.
Ю.КозулицТна Т.Н. Туберкулез органов дыхания / Под ред. А.Г. Хоменко. - М., 1988. - С. 5-26, 110-122.
1 1 . Куликовская Н.В..Литвинов В.И. Серологические исследования для дифференциальной диагностики туберкулеза и нетуберкулезных заболеваний легких II Лабораторная диагностика туберкулеза: Сб. науч. тр.-М., 2001.-С, 127-128.
Крофтон Джон, Хорн Норман, Миллер Фред. Клиника туберкулеза. - М,: Медицина, 1996. - С. 7-8.
Литвинов В.И. Лабораторная диагностика туберкулеза: Сб. к/5-летию ведущего противотуберкулезного учреждения г. Москвы. - М., 2001.-С. 216-220.
Медицинская микробиология: Учебная литература для студентов медицинских вузов и врачей. -М., 1998. -С. 499-516.
Митинская Л.А. Противотуберкулезная ревакцинация 5ЦЖ. -М.: Медицина, 1975.
Микробиологические исследования при выявлении, диагностике и лечении туберкулеза: Руководство. - М., 2001.
Модель Л.М. Биология и биохимия туберкулезных микобактерий.-М., 1952.
Оттен Т.Ф., Васильев А.В. Микобактериоз. - М.-СПб., 2005.
Пальцев М. Молекулярная биология; к тайнам 1ШиЬегси1оз1з. // «Медицинская газета». - 2003. - № 39.
20. Пузик В.И. Проблемы иммуноморфологии туберкулеза. - М., 1966.
21.0 совершенствовании противотуберкулезных мероприятий в Российской Федерации: Приказ МЗ РФ № 109 от 21 марта 2003 г.
Перельман М.И., Корякин В.А., Богадельникова И.В. Фтизиатрия: Учебная литература для студентов медицинских вузов. - М., 2004. - С. 30-37.
РабухинА.Е. Химиотерапия больных туберкулезом.-М., 1970.
Соколова Г.Б. Рифабутин в комплексной терапии туберкулеза: Пособие для врачей. - М., 2001.
Струков А.И., Соловьева И.П. Морфология туберкулеза в со временных условиях. - М., 1986.
Яновская М. Роберт Кох. Жизнь замечательных людей. - М., 1962.
Чеботарева Т.В. Лечебно-профилактические мероприятия по обеспечению здоровья детей, рождающихся от больных туберкулезом женщин: Дис... д-ра мед. наук. - М., 1990.
Ященко Т.М., Мечева И.С. Руководство по лабораторным исследованиям при туберкулезе. - М., Медицина, 1973.
Рональд В.Смитвик. Лабораторный справочник по микроскопии кислотоустойчивых бактерий: Пер.с англ. - М., 1979.
