
- •Биохимия мышечной ткани
- •1. Функции и виды мышечной ткани
- •Поперечно-полосатая мускулатура
- •Механизм мышечного сокращения
- •Регуляция мышечного сокращения. Тропомиозин
- •2. Регуляция сокращения и расслабления мышц в живой клетке
- •3. Механизмы энергообеспечения мышечной ткани
- •Специальные реакции субстратного фосфорилирования
- •4. Изменение метаболизма при мышечной работе
Лекция №31. Биохимия нервной ткани.
1. ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ.
2. ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В НЕРВНОЙ ТКАНИ.
3. ХИМИЧЕСКАЯ ПЕРЕДАЧА НЕРВНОГО ВОЗБУЖДЕНИЯ.
ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ. Функции нервной системы:
1. координация и регуляция обмена веществ,
2. обеспечение связи организма с внешней средой.
Химический состав нервной ткани сложен и неоднороден, как в целом и сама нервная ткань. Отличия в химическом составе носят в основном количественный характер. В сером веществе 77 -81% воды, в белом-70%. Содержание белков в нервной ткани меньше, чем в некоторых других тканях (печень, мышцы). Их больше в сером веществе и меньше в периферических нервах. В нервной ткани содержится больше сложных белков: ЛИПОПРОТЕИНЫ (миелиновые оболочки), ФОСФОПРОТЕИНЫ, НУКЛЕОПРОТЕИНЫ (ДНП, РНП), ГЛИКОПРОТЕИНЫ (нейрокератин), En.
Наибольший интерес представляют нейроспецифические белки:
1. белок S-100 (растворим в 100% растворе (NH4)2SO4). Он повышается в ткани мозга в эксперименте при обучении и эмоциональном воздействии. Считают, что этот белок отвечает за формирование зависимостей (алкогольной, наркотической). ПРОПРОТЕИН - антитело к белку S-100, понижает его содержание в ткани мозга.
2. Белок 14-3-2 играет важную роль в формировании памяти.
3. НЕЙРОПЕПТИДЫ - играют роль нейромедиаторов и гормонов. Пептиды памяти, боли, сна. Не белковые азотистые соединения те же самые, что и в других тканях, но отличаются по
количественному составу. В нервной ткани много свободных аминокислот, г.о. дикарбоновых (ГЛУ, ГЛН, ACП, АСН), ГАМК, ароматические аминокислоты, ЦАМФ и ЦГМФ. Углеводов незначительное количество:
1. резервные углеводы - гликоген (0,1 %)
2. глюкоза (1 -4мкмоль/л)
3. гексозофосфаты
4. триозофосфаты
5. ПВК
6. молочная кислота.
ЛИПИДОВ в сером веществе 25%, в белом веществе 50%.
1. ФОСФОЛИПИДЫ (до 50%) - ПЛАЗМОГЕН АЦЕТАЛЬФОСФАТИДЫ.
2. ГЛИКОЛИПИДЫ - ЦЕРЕБРОЗИДЫ, ГАНГЛИОЗИДЫ.
3. ВЖК - в основном непредельные, содержащие по 4 - 5 двойных связей.
4. Холестерин (25%) в свободном виде. Мозг даже называют депо холестерина.
5. Нейтральные жиры - в незначительном количестве в головном, но в большом количестве в периферических нервах.
Минеральные вещества представлены катионами калия, натрия, кальция, магния, железа, меди, цинка, в качестве анионов выступают анионы белков и фосфаты.
ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В НЕРВНОЙ ТКАНИ. Особенности энергетического обмена.
1. В ткани головного мозга очень высока интенсивность дыхания. Мозг потребляет кислород больше, чем постоянно функционирующий миокард, на 20% больше покоящиеся мышцы. 20 - 25% всего кислорода приходится на долю головного мозга, у детей грудного возраста -50%. За 10 секунд мозг поглощает весь кислород, находящийся в ткани. Из этого следует особая важность адекватного кровоснабжения нервной ткани. Прекращение кровоснабжения ГМ 6 -8 секунд приводит к потере сознания.
2. Основным субстратом окисления является глюкоза. ДЫХ. КОЭФ.=V(СО2)/V(О2)=1,0
Мозг это единственный орган, использующий в качестве источника энергии исключительно глюкозу.
3. До 70% АТФ используется для поддержания ионных градиентов (удаление натрия из клетки).
ОСОБЕННОСТИ УГЛЕВОДНОГО ОБМЕНА.
Исходный субстрат окисления - глюкоза. 85% окисляется аэробно. Функция головного мозга зависит от концентрации глюкозы в крови. ГИПОГЛИКЕМИЯ ведёт к судорогам, смерти. 0,1% гликогена обновляется в ткани мозга за 4 часа. Распад идет двумя путями: ФОСФОРОЛИТИЧЕСКИМ и ГИДРОЛИТИЧЕСКИМ.
При нарушении обмена углеводов нарушается функция головного мозга. Эффект снотворных веществ связан с торможением окисления углеводов. Недостаток витамина BI ведёт к нарушению углеводного обмена и полиневритам.
ОСОБЕННОСТИ ОБМЕНА БЕЛКОВ И АМИНОКИСЛОТ.
При возбуждении нервной ткани нарушается распад белков и аминокислот и повышается содержание аммиака в клетках. Во время торможения и сна количество аммиака снижается. Аммиак токсичен для ткани головного мозга и обезвреживается ГЛУ с образованием амидов (ГЛН)
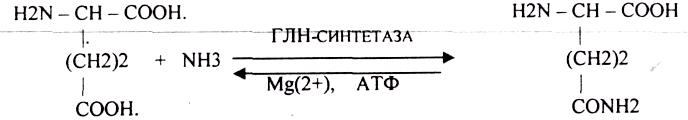
ГПН проникает через мембраны и выходит из клетки.
РОЛЬ ГЛУТАМИНОВОЙ КИСЛОТЫ В ОБМЕНЕ ВЕЩЕСТВ.
1. ГЛУ связывает аммиак
2. ТРАНСАМИНИРОВАНИЕ, следовательно, образование заменимых аминокислот
3. ДЕКАРБОКСИЛИРОВАНИЕ
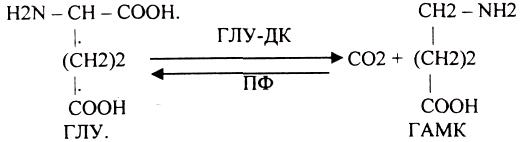
4 ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
5. Является нейромедиатором возбуждающего действия
6. Стабилизирует содержание калия в клетке.
До 10% глюкозы превращается в нервной ткани в ГЛУ. ГЛУ применяется в качестве лечебного средства при ЧМТ.
ОСОБЕННОСТИ ЛИПИДНОГО ОБМЕНА.
Нейтральные жиры не используются как энергетический материал в нервной ткани. ФОСФО и ГЛИКОЛИПИДЫ играют в основном структурную роль, как компоненты мембран.
ХИМИЧЕСКАЯ ПЕРЕДАЧА НЕРВНОГО ВОЗБУЖДЕНИЯ. Химическими передатчиками являются нейромедиаторы:
1. АЦЕТИЛХОЛИН
2. БИОГЕННЫЕ АМИНЫ
3. АМИНОКИСЛОТЫ (ГЛУ, ГЛИ)
4. НЕЙРОПЕПТИДЫ.
В передаче нервного возбуждения участвуют:
1. Натриевый насос (АТФ -аза)
2. Натриевые каналы
3. Калиевые каналы.
Этапы передачи нервного возбуждения.
1. Нервный импульс
2. Освобождение медиатора
3. Диффузия медиатора через синаптическую щель
4. Присоединение медиатора к рецептору
5. Изменение конфигурации рецептора
6. Открытие калий -натриевых каналов
7. Инактивация медиатора
8. Удаление натрия из клетки с помощью АТФ-азы.
В покое натрий удаляется из клетки, и мембрана становится проницаемой для калия. Калий выходит из клетки и внутри клетки наблюдается положительный потенциал - ПП (70мВ) При возбуждении натрий -калиевые каналы открываются, натрий заходит в клетку, калий выходит из клетки. Но т.к. концентрация натрия снаружи больше, его в клетку заходит больше. Это приводит к понижению отрицательного заряда внутри клетки и мембрана деполяризуется. Это и есть начало передачи импульса по мембране. ОБРАЗОВАНИЕ НЕЙРОМЕДИАТОРОВ. В ХОЛИНЕРГИЧЕСКИХ синапсах основной медиатор - АЦЕТИЛХОЛИН. Образуется из холина.
![]()
Ацетилхолин разрушается с помощью ХОЛИНЭСТЕРАЗЫ.
В АДРЕНЕРГИЧЕСКИХ синапсах медиаторы образуются из ТИР.
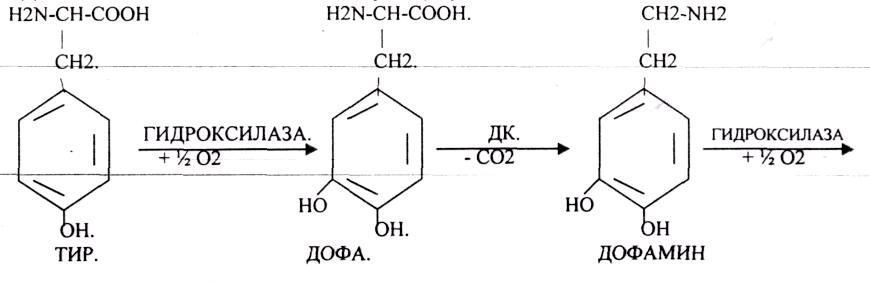
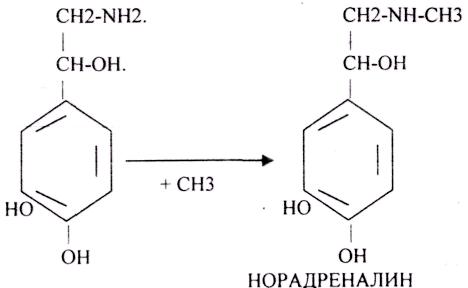
В СЕРОТОНИНЕРГИЧЕСКИХ синапсах медиатор образуется из ТРИ.
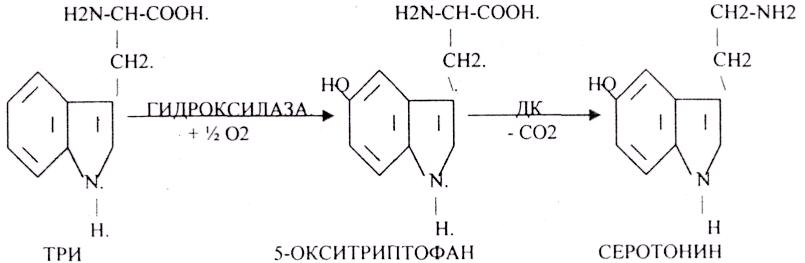
Они разрушаются МОНОАМИООКСИДАЗОЙ (МАО).
Биохимия мышечной ткани
1. Функции и виды мышечной ткани
Мышечная ткань составляет 40 % от веса тела человека. Биохимические процессы, протекающие в мышцах, оказывают большое влияние на весь организм человека.
Функция мышц - и постоянной температуре. Ни один искусственный механизм к этому неспособен. Механическое движение, в котором химическая энергия превращается в механическую при постоянном давлении.
Поперечно-полосатая мускулатура
Функциональная единица - саркомер.
Толстая нить. Состоит из молекул белка миозина. Миозин - крупный олигомерный белок, молекулярная масса 500 кДа, состоит из 6 субъединиц, попарно одинаковых.
Тяжелая цепь: на С-конце - -спираль, на N-конце - глобула. При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет 2 отдела, где спирали оголены - эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность.
Свойства миозина.
1. В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками ("конец в конец", "бок в бок") с помощью слабых типов связей. Взаимодействуют только стержни, головки остаются свободными.
2. Молекула миозина обладает ферментативной активностью (АТФ-азная активность: АТФ + Н2О-->АДФ + Ф). Активные центры расположены на головках миозина.
Стадии ферментативной реакции.
1-я стадия. Сорбция субстрата. В ходе этой стадии АТФ фиксируется на адсорбционном участке активного центра головки миозина.
2-я стадия. Гидролиз АТФ. Происходит на каталитическом участке активного центра головки. Продукты гидролиза (АДФ и Ф) остаются фиксированными, а выделившаяся энергия аккумулируется в головке.
Примеч.: чистый миозин in vitro обладает АТФ-азной активностью, но она очень низка.
3-я стадия. Миозин способен взаимодействовать с актином тонких нитей. Присоединение актина к миозину увеличивает АТФазную активность миозина, в результате скорость гидролиза АТФ возрастает в 200 раз. Ускоряется именно 3-я стадия катализа. Освобождение продуктов реакции (АДФ и Ф) из активного центра головки миозина.
Примечание: чистый миозин обладает ферментативной активностью, но она очень низкая.
Миозин своими головками способен взаимодействовать с актином (актин- сократительный белок), входящим в состав тонких нитей.
Присоединение актина к миозину мгновенно увеличивает АТФ-азную активность миозина (больше, чем в 200 раз). Актин является аллостерическим активатором миозина.
Тонкие нити. В состав тонких нитей входят три белка: сократительный белок актин; регуляторный белок тропомиозин; регуляторный белок тропонин.
Актин - небольшой глобулярный белок, его молекулярная масса - 42 кDа. G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации, образуя F-актин.
В состав тонкой нити входят две F-актиновые нити, образуется суперспираль (2 перекрученные нити). В области Z-линий актин прикрепляется к a-актинину.
