
- •Министерство образования республики беларусь
- •Глава 2. Результаты и их обсуждение
- •Список сокращений и обозначений
- •Введение
- •Глава 1. Материалы и методы
- •Характеристика объекта исследования
- •Питательные среды и физические условия культивирования
- •Состав основной питательной среды mс, использованной в работе
- •Состав модифицированной питательной среды Mурасиге и Скуга
- •1.3. Иммобилизация клеток суспензионной культуры в
- •1.4. Определения активности фенилаланинаммиак-лиазы
- •1.5. Количественное определение содержания фенольных соединений
- •1.6. Статистическая обработка данных
- •Глава 2. Результаты и их обсуждение
- •Заключение
- •Список литературы
1.3. Иммобилизация клеток суспензионной культуры в
Са-альгинатном геле
Для иммобилизации клеток эхинацеи пурпурной в Са-альгинатные гранулы клетки суспензионной культуры, находящейся в стационарной фазе роста, отмывали свежей средой, а затем отбирали равные объемы (10 мл) полученной суспензии клеток и переносили в стаканчики с 10 мл стерильного альгината натрия в концентрации 3%. Смесь клеток с альгинатом натрия с помощью стерильного пластмассового шприца по каплям переносили в чашку Петри с 40 мл стерильного раствора 0,25 М хлорида кальция. Образовавшиеся гранулы геля с включенными клетками оставляли в растворе СаСl2 на 20 минут, а затем проводили трехкратный отмыв равными порциями стерильный дистиллированной воды. Полученные Са-альгинатные гранулы с включенными в них клетками помещали в 100 мл конические колбы с 25 мл среды для культивирования.
В качестве контроля служили свободные клетки суспензионной культуры эхинацеи пурпурной, которые вносили в объеме 10 мл клеточной суспензии на 25 мл среды для культивирования.
1.4. Определения активности фенилаланинаммиак-лиазы
Для выделения фермента навеску каллусной ткани (2,5 г) растирали в ступке с небольшим количеством боратного буфера (рН 8,8). Доводили объем пробы до 25 мл. Оставляли на 30 мин при температуре +4ºС. Затем гомогенат центрифугировали 10 мин при 10 000 об/мин. Надосадочную жидкость (супернатант) использовали для определения активности фермента. Реакционную смесь, которая включала 2 мл супернатанта (ферментного препарата), 2 мл боратного буфера, содержащего 50 ммоль/л фенилаланина, 2 мл боратного буфера, выдерживали в течение 1 часа в условиях термостата при +40ºС. Затем производили измерение оптической плотности при длине волны 290 нм. Контролем служила реакционная смесь, выдержанная в аналогичных условиях, которая содержала 2 мл супернатанта (ферментного препарата) и 4 мл боратного буфера.
Определение белка производили по методу Брэдфорд (Bradford, 1976; Степанченко и др., 2011). Его содержание рассчитывали с помощью калибровочной кривой, построенной для бычьего сывороточного альбумина (БСА) (рис. 1.1).
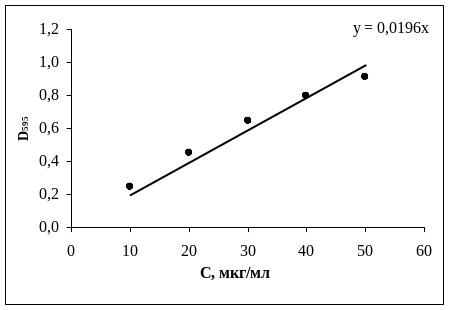
Рис. 1.1. Калибровочная кривая для определения содержания белка:
по оси ОХ – концентрация БСА.
Активность фермента определяли в нмоль коричной кислоты/ (мг белка·мин) исходя из того, что изменение поглощения при 290 нм на 0,01 эквивалентно образованию 3,09 нмоль коричной кислоты (Zucker, 1968; Saunders, McClure, 1974).
1.5. Количественное определение содержания фенольных соединений
Для анализа содержания ФС в свободных и иммобилизованных клетках эхинацеи пурпурной в работе получали водно-спиртовые экстракты (Запрометов, 1993). Для этого точную навеску высушенного сырья (0,1 г) тщательно растирали в ступке с добавлением небольшого количества 70 %-ного этанола, затем доводили объем до 10 мл. Полученную массу переносили в коническую колбу объемом 50 мл. Экстрагирование проводилось в течение 1 часа при нагревании на водяной бане с обратным холодильником. Затем полученный экстракт фильтровали через бумажный фильтр, с помощью этанола доводили объем до 10 мл (раствор А).
На следующем этапе в пробирку или мерный цилиндр объемом 10 мл вносили 1 мл полученного экстракта, 7 мл дистиллированной воды, 1 мл реактива Фолина-Дениса, через 2 минуты добавляли 1 мл насыщенного раствора углекислого натрия. Полученную смесь (раствор А) оставляли на 1 час до проявления окраски. Контролем служил вариант, в котором в пробирку вносили 1 мл 70%-ого этанола, 7 мл дистиллированной воды, 1 мл реактива Фолина-Дениса, 1 мл насыщенного раствора углекислого натрия. Измерение оптической плотности проводили с помощью спектрофотометра при длине волны 720 нм.
Расчет содержания ФС в пересчете на феруловую кислоту производили по формуле:
Р · V1
С= , (1.2)
а · m
где
С – содержание фенольных соединений (мг/г сух.в.);
E – оптическая плотность раствора;
а – калибровочный коэффициент, полученный из графика концентрационной зависимости оптической плотности комплекса феруловой кислоты с реактивом Фолина-Дениса при 720 нм (рис. 1.2;
V – общий объем экстракта (мл);
m – навеска биологического материала для анализа (г сухой массы).
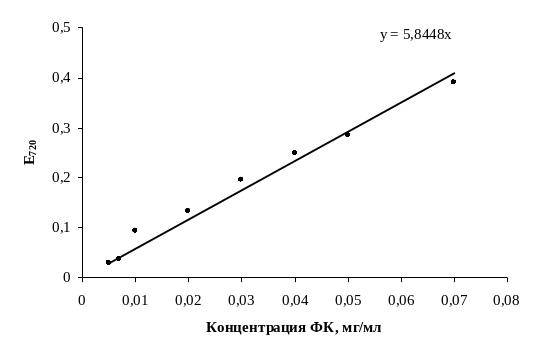
Рис. 1.2. Калибровочная кривая:
по оси ОX – концентрация феруловой кислоты (мг/мл),
по оси ОY – оптическая плотность раствора комплекса феруловой кислоты
с реактивом Фолина-Дениса при 720 нм
